本试题 “已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度, 第二步电离程度远大于第三步电离程度……,今有HA、H2B、H3C三种弱酸,根...” 主要考查您对强酸和弱酸的比较
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强酸和弱酸的比较
- 弱电解质的电离
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 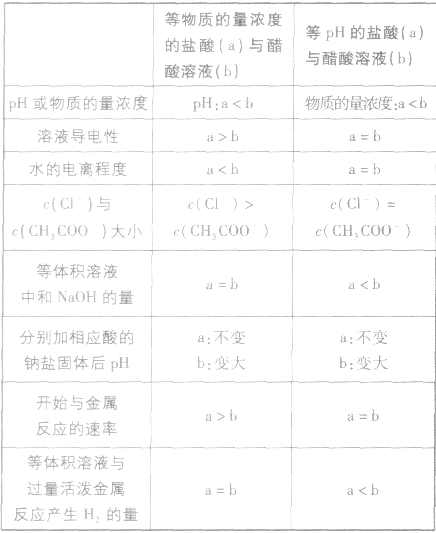
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 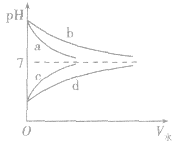
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
发现相似题
与“已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程...”考查相似的试题有:
- 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是[ ]A.II为盐酸稀释时...
- 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:(1)不考虑其他组的实验结果...
- 今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:(在空白处填上相应的字母)A.①>②>③B.①<②<③C.①=②=③D.①=③>②E.①>②=...
- 在下列叙述中,不能说明盐酸是强酸,醋酸是弱酸的是A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多B.氯...
- 某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ① pH=1的强酸溶液,加水稀释后,溶液中各...
- 甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b...
- 25℃时,弱酸的电离平衡常数如下表,下列表述错误的是弱酸CH3COOHHCNH2CO3K1.8×10-54.9×10-10K1=4.3×10-7 K2=5.6×10-11A....
- 已知25℃时部分弱电解质的电离平衡常数数据如下表:化学式CH3COOHH2CO3HClO平衡常数Ka=1.8×10-5Ka1=4.3×10-7Ka2=5.6×10-11Ka=3...
- 下列各选项中所述的两个量,前者一定大于后者的是( )A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数B....
- 对0.1mol•L-1的醋酸溶液进行以下操作,下列分析判断正确的是( )A.加入少量0.1mol•L-1的硫酸,水电离产生的c(H+)减小B....