本试题 “进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )A.将N2和过量的O2在高温或放电的...” 主要考查您对氧化性、还原性强弱的比较
(浓)硫酸
一氧化氮
二氧化氮
金属的焰色反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化性、还原性强弱的比较
- (浓)硫酸
- 一氧化氮
- 二氧化氮
- 金属的焰色反应
硫酸:
硫酸的分子式:H2SO4;结构式: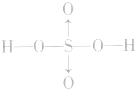 ,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
,H2SO4中硫元素为+6价,处于最 0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
硫酸的物理性质和化学性质:
1.硫酸的物理性质
纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。常见浓硫酸的质量分数为98.3%,其密度为 1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质
稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应
(3)与碱性氧化物或碱性气体反应 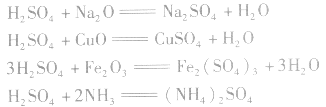
(4)与活泼金属发生置换反应 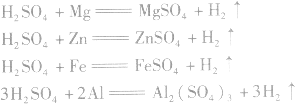
(5)与某些盐溶液反应 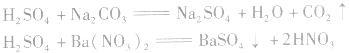
4.浓硫酸的特性
(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。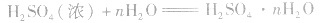 。
。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物: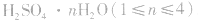 。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有
。这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。能够用浓H2SO4干燥的气体有 、
、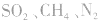 等酸性或中性气体,而具有还原性的气体
等酸性或中性气体,而具有还原性的气体 和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如
和碱性气体NH3则不能用浓H2SO4干燥。另外在酯化反应中,如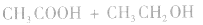
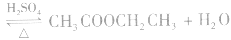 中,浓H2SO4作催化剂和吸水剂。
中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如: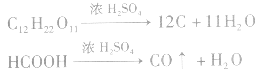
(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。但热的浓 H2SO4能氧化大多数金属(除金、铂外)、某些非金属单质及一些还原性化合物。如: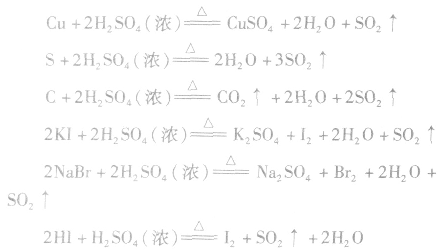
在这些氧化还原反应中,浓硫酸的还原产物一般为SO2。
浓、稀硫酸的比较与鉴别:
1.比较
稀硫酸—弱氧化性—可与活泼金属反应,生成H2—氧化性由H+体现。
浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由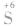 体现。
体现。
2.鉴别
从浓H2SO4和稀H2SO4性质的差异人手,可知鉴别浓H2SO4和稀H2SO4的方法有多种。
方法一:取少量蒸馏水,向其中加入少量试样硫酸,如能放出大量热则为浓H2SO4,反之则为稀H2SO4。
方法二:观察状态,浓H2SO4呈黏稠状,而稀H2SO4为黏稠度较小的溶液。
方法三:用手掂掂分量,因为浓H2SO4的密度较大 (1.84g·cm-3,相同体积的浓H2SO4和稀H2SO4,浓H2SO4的质量比稀H2SO4大很多。
方法四:取少量试样,向其中投入铁片,若产生气体,则为稀H2SO4, ;若无明显现象(钝化),则为浓H2SO4。
;若无明显现象(钝化),则为浓H2SO4。
方法五:用玻璃棒蘸取试样在纸上写字,立即变黑 (浓H2SO4的脱水性)者为浓H2SO4,另一种为稀H2SO4。
方法六:取少量试样,分别投入一小块铜片,稍加热发生反应的(有气泡产生)为浓H2SO4。(浓H2SO4的强氧化性),无现象的是稀H2SO4.
硫酸的用途及使用:
(1)用途硫酸是化学工业最黄要的产品之一,它的用途极广(如下图)。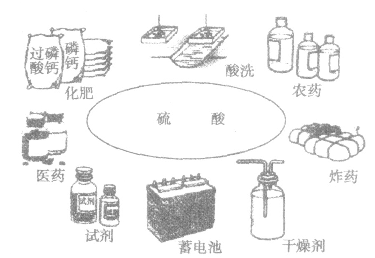
①利用其酸性可制磷肥、氮肥,可除锈,可制实用价值较高的硫酸盐等。
②利用其吸水性,在实验室浓H2SO4常用作干燥剂。
③利用其脱水性,浓H2SO4常作精炼石油的脱水剂、有机反应的脱水剂等。
④利用浓H2SO4的高沸点和难挥发性,常用于制取各种挥发性酸。
⑤浓H2SO4常作有机反应的催化剂。
(2)浓硫酸的安全使用
①浓H2SO4的稀释稀释浓硫酸时应特别注意:将浓硫酸沿器壁慢慢地注入水中,并不断搅拌,使产生的热量迅速地扩散出去。切不可把水倒人浓硫酸里。两种液体混合时,要把密度大的加到密度小的液体中,如浓H2SO4、浓HNO3-混合酸的配制方法是把浓H2SO4沿器壁慢慢地注入浓HNO3中。
②万一不小心将浓硫酸溅到皮肤上、衣服上或桌面上,应分别怎样处理?
皮肤上:用干布迅速拭去,再用大量水冲洗,最后涂上3%~5%的碳酸氢钠溶液。
衣服上:用大量水冲洗。
桌面上:大量时,用适量。NaHCO3,溶液冲洗,后用水冲洗,再用抹布擦干;少量时用抹布擦即可。
氮元素有+1、+2、+3、+4、+5五种正价,五种正价对应六种氧化物N2O(俗称“笑气”,具有麻醉作用)、 NO、N2O4(暗蓝色气体)、NO2、N2O4、N2O5(白色固体)。其中N2O3和N2O5分别是HNO2和HNO3的酸酐,它们都是空气污染物,空气中的NO2是造成光化学污染的主要因素。另外,在思考某些问题时,要注意:2NO2
 N2O4。对气体体积及平均相对分子质量的影响:
N2O4。对气体体积及平均相对分子质量的影响:一氧化氮的物理性质和化学性质:
(1)物理性质:无色、不溶于水、有毒的气体,密度比空气稍重。
(2)化学性质:
①极易被空气中的O2氧化: 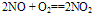
②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性。
二氧化氮的物理性质和化学性质:
(1)物理性质:红棕色、有刺激性气味、有毒的气体,易溶于水、易液化,比空气重。
(2)化学性质:
与H2O反应: 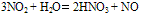
(工业制HNO3原理,在此反应中,NO2同时作氧化剂和还原剂)
NO、NO2的性质、实验室制法的比较:
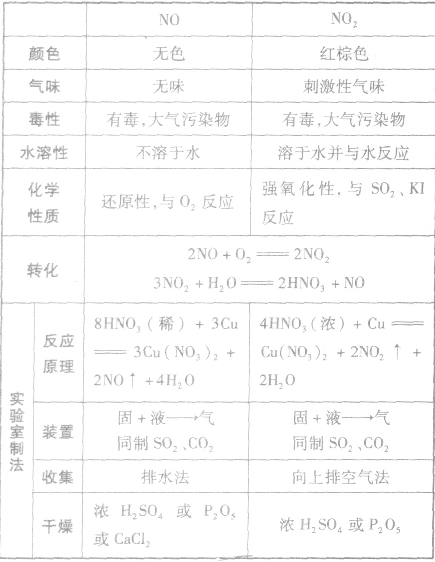
隐含反应: 的应用:
的应用:
通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生反应 ,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
,由于此平衡的存在,导致一些物理量的理论值与实验值有一定的误差。例如:
1.收集到的1mo1NO2在标准状况下的体积应小于22.4L
2.标准状况下22.4LNO2的质量大于46g。
3.NO与O2混合后,所得物质的相对分子质量应大于按体积比求得的数值。
4.温度影响“ ”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
”平衡体系,其他条件不变,体系颜色随温度改变而改变。升高温度,气体颜色变深;降低温度,气体颜色变浅。
5.恒容时,在“ ”平衡体系中增加 N01,相当于增大压强。
”平衡体系中增加 N01,相当于增大压强。
有关混合气体NO、NO2、O2溶于水的计算:
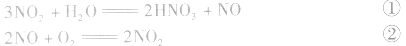
①×2+②得NO2、O2与水反应生成HN3,的化学方程式为: 
①×2+②×3得NO、O2与水反应生成HNO3的化学方程式为: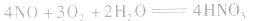
一般NO、NO2、O2与水反应,可归纳成四种情况:
1.NO和NO2混合 剩余气体为NO
剩余气体为NO
2.NO2和O2混合
3.NO和O2混合 
4.NO2、NO、O2的混合
当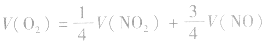 时,反应后无气体剩余
时,反应后无气体剩余
特例:当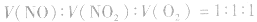 时,无气体剩余。
时,无气体剩余。
(1)有些金属或它们的化合物在灼烧时会使火焰呈现出特色的颜色的想象。
(2)操作:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至于酒精灯颜色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
(3)常见的颜色反应
Li Na K Ca Sr Ba Cu
紫红 黄 紫(透过蓝色钴玻璃片) 砖红 洋红 黄绿 绿
①焰色反应为物理变化过程。
②焰色现象与金属元素的存在有关,与物质组成无关。如:钠元素的焰色为黄色,包括钠单质以及钠的所有化合物。
与“进行化学实验、观察实验现象,通过分析、推理得出正确的结论...”考查相似的试题有:
- 向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成...
- 某兴趣小组设计出下图所示装置来进行“铜与硝酸反应”实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸...
- 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变...
- 教材中经常利用如图装置进行有关物质的制备和性质检验(1)请按要求填充下表空格(2)针对上述实验下列说法正确的是________(填字...
- 张明同学设计下图所示装置,用粗铁粒与1890g·L-1(质量分数10%)的硝酸反应制取NO气体。请回答有关问题。①1890g·L-1硝酸的物质...
- 同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和H2.现将3支试管均倒置于...
- 以下物质间的每步转化通过一步反应能实现的是[ ]A.Al→Al2O3→Al(OH)3→NaAlO2B.Fe→FeCl2→Fe(OH)2→Fe(OH)3C.S→SO3→H2SO4→MgSO...
- 下列物质的使用不涉及化学变化的是A.明矾用作净水剂B.液氨用作制冷剂C.氢氟酸刻蚀玻璃D.生石灰作干燥剂
- 水是生命之源,也是化学反应中的主角。试回答下列问题:I.A、B、C均是中学化学常见的三种短周期元素组成的有色物质,摩尔质...
- 有90mL无色混合气体,其中可能有NH3,HCl,CO2,NO,把混合气体通过浓硫酸,气体的体积减少了10mL,再通过过氧化钠固体,气体...