本试题 “(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)随加入盐酸体积变化曲线如右图所示。(1)下列有关说法正确的是___________ A.a点...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有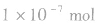 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中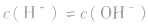

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即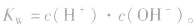
(1)在一定温度下,水的离子积都是一个常数,在25℃时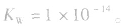
(2)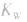 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,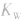 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
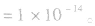
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,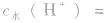
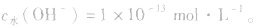
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中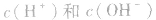 的乘积总是
的乘积总是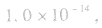 知道
知道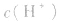 就可以计算出
就可以计算出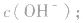 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即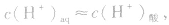 而OH-是由水电离产生的:
而OH-是由水电离产生的: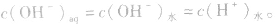
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即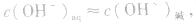 而H+是由水电离产生的:
而H+是由水电离产生的: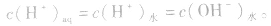
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且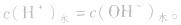
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


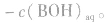
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
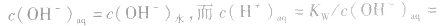
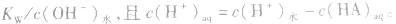
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,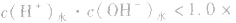
 发生水解的盐溶液中
发生水解的盐溶液中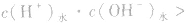
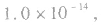 但
但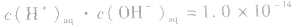 总成立。
总成立。
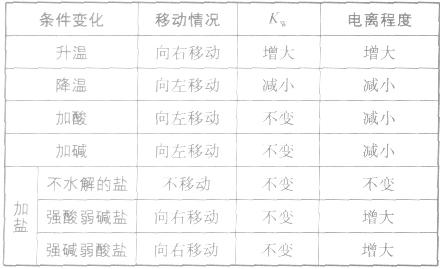
影响水电离平衡的因素:
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,...”考查相似的试题有:
- (7分)25℃,NaOH和Na2CO3两溶液的pH均为11.(1)两溶液中,由水电离出得c(H2O)分别是①NaOH中 ,②Na2CO3中 ,③在1L水中加入上...
- (8分)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:(1)该温度下,水的离子积常数kw= 。(2...
- 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理...
- 在醋酸与氢氧化钠溶液的反应完成后,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该...
- 有关下列两种溶液的说法中,正确的是( )溶液①:0.2mo1•L-1CH3COONa溶液;溶液②:0.1mo1•L-1H2SO4溶液.A.相同温度下,溶液...
- (7分)常温下,两种溶液:①0.1 mol/L HAC ②0.1 mol/L NaAC。(1)溶液①的pH 7(填“>”、“”或“
- 有甲、乙两瓶溶液,已知甲溶液的pH是4,乙瓶溶液的pH是6,现从甲瓶溶液中取出10mL,用蒸馏水稀释至1L得溶液丙,则下列说法中...
- 下列溶液一定显酸性的是( ) A.溶液中c(OH-)>c(H+) B.滴加紫色石蕊试液后变红色的溶液 C.溶液中c(H+)=10-6 mol/L ...
- 纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是[ ]A.大于B.等于C.小于D.不能肯定
- 25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是( )A.弱碱 B.一...