本试题 “下列说法正确的是( )A.用坩埚灼烧MgCl2·6H2O的反应式:MgCl2·6H2OMgCl2+6H2OB.KSCN和FeCl3混合液着存在平衡:3KSCN+FeCl3Fe(SCN)3+3KCl,加入少量KCl固体后...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有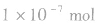 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中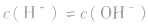

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即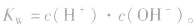
(1)在一定温度下,水的离子积都是一个常数,在25℃时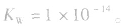
(2)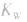 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,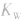 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
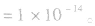
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,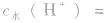
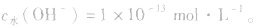
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中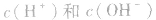 的乘积总是
的乘积总是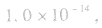 知道
知道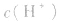 就可以计算出
就可以计算出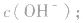 反之亦然
反之亦然
1.酸溶液
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即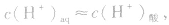 而OH-是由水电离产生的:
而OH-是由水电离产生的: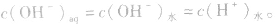
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即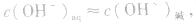 而H+是由水电离产生的:
而H+是由水电离产生的: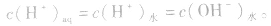
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且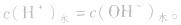
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


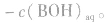
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
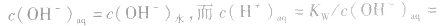
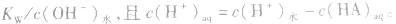
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,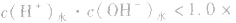
 发生水解的盐溶液中
发生水解的盐溶液中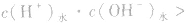
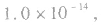 但
但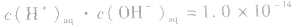 总成立。
总成立。
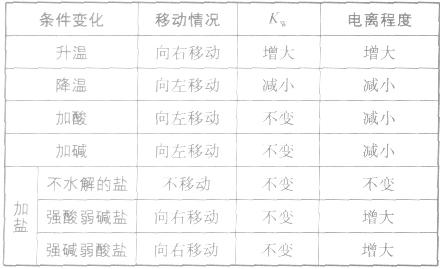
影响水电离平衡的因素:
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“下列说法正确的是( )A.用坩埚灼烧MgCl2·6H2O的反应式:MgCl2...”考查相似的试题有:
- 在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( )A.图中五点Kw间的关系:B>C>A=D=EB.C点一定是纯水C...
- 已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是A.等温浓度均为0.1 mol·L-1的HA、HB溶液中,其...
- 向纯水中加入少量的KHSO4固体(温度不变),则溶液的( )A.pH值减小 B.c(H+)和c(OH-)的乘积增大C.酸性减弱 D.OH-离...
- (14分)下表是不同温度下水的离子积数据:温度/℃25t1t2Kw/ mol2·L-21×10-14a1×10-12试回答以下几个问题:(1)若25< t1< t2,...
- 常温时,将pH为5的HCl溶液与pH为2的HCl溶液等体积混合后,溶液的氢氧根离子浓度最接近于 ( )A.2×10-12mol/LB.1/2(10-9+1...
- 现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是A.加入10mL 0.01mol·L-1的NaOH溶液B.加入10mL 的水进行...
- 0.1 mol?L-1KHS溶液中下列表达式不正确的是( )A.c(K+)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-)B.c(K+)> c(HS-)> c(OH-)> c(S2-)>...
- 短周期元素W、X、Y、Z的原子序数依次增大,它们的简单离子中都能破坏水的电离的组合是A.Y3+、W-B.Z2-、X+C.X+、Y3+D.X+、Z2-
- 某探究小组在某温度下测定溶液的pH值时发现,0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22(mol·L-1)2,则该...
- 醋酸水溶液中的PH为2时,该溶液中C(OH—)是 ( )A.1×10-7mol·L-1B.1×10-2mol·L-1C.1×10-14mol·L-1D.1×10-12mol·L-1