本试题 “运用铁及其化合物的知识,完成下列各题.(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是_______A.盐酸 B.氯气 C.CuSO4溶液 D.稀硫酸...” 主要考查您对氧化剂、还原剂
单质铁
铁盐(三价铁离子)
亚铁盐(二价铁离子)
物质的除杂
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 单质铁
- 铁盐(三价铁离子)
- 亚铁盐(二价铁离子)
- 物质的除杂
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 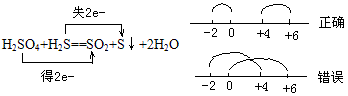
铁元素:
在元素周期表中的位置:铁的原子序数26,位于周期表中第四周期,第Ⅷ族。
(1)物理性质:银白色、有金属光泽,密度较大,熔点较高,硬度较小,具有导电、导热、延展性,可被磁铁吸引。
(2)化学性质:较活泼的金属,+2、+3价两种价态
①与强氧化剂反应(如:Cl2 Br2 过量稀HNO3)生成+3价铁的化合物。如: 
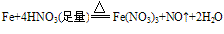
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S I2 H+ Cu2+)生成+2价铁的化合物,如: 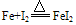
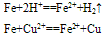
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁的性质:
- 物理性质:铁是黑色金属,具有铁磁性
- 铁的化学性质:
①与强氧化剂反应(如:Cl2、 Br2 、过量稀HNO3)生成+3价铁的化合物。如:
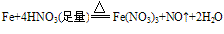
注:铁常温下在浓硫酸和浓硝酸中钝化,但加热可以反应,且被氧化成Fe3+
②与弱氧化剂反应(如S、 I2 、H+ 、Cu2+)生成+2价铁的化合物,如: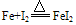
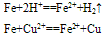
③铁与氧气、水蒸气反应生成Fe3O4(FeO·Fe2O3)

铁与稀硝酸的反应:
- 铁少量时:
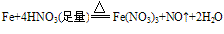
- 铁过量时:3Fe+8HNO3==3Fe(NO3)2+2NO+4H2O
两式可通过2Fe3++Fe==3Fe2+联系起来。
注意:
- 铁元素性质活泼,自然界中的铁元素几乎都是以化合态存在,只有在陨石中存在游离态的铁元素。
- 过量的铁与氯气反应,不会生成FeCl2,因为铁还原三价铁必须在水溶液中进行。
- 金属与强氧化性酸反应,不会生成H2。
化学性质:
铁元素性质活泼,有较强的还原性。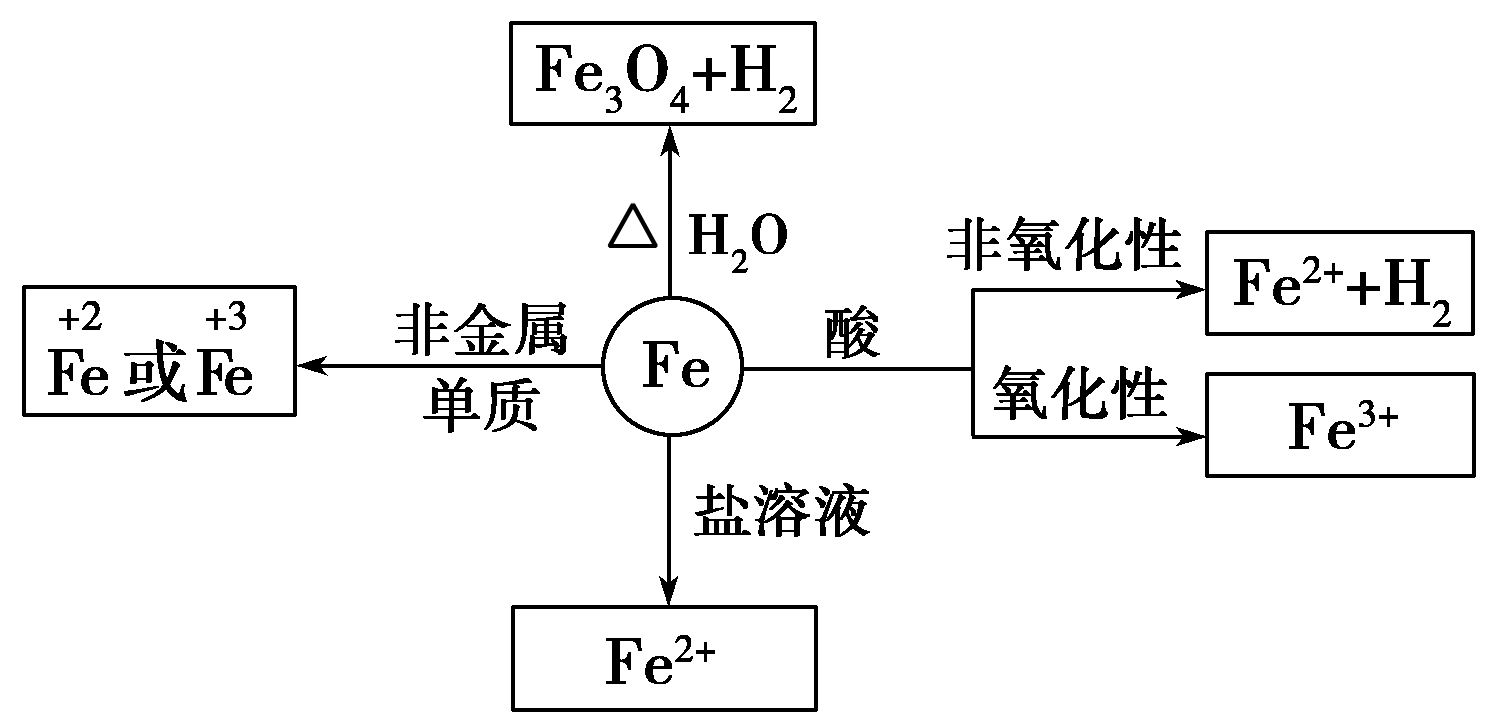
铁三角关系:

Fe3+的性质:
含Fe3+的溶液都呈黄色,具有氧化性,
(1)与还原剂反应生成二价铁 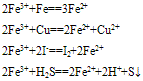
(2)与碱反应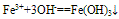
(3)Fe3+在水中易水解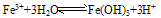
由于三价铁易水解,在保存铁盐盐溶液(FeCl3)时加入少量相应的酸(HCl),以防止Fe3+水解。
“铁三角”中的转化关系:
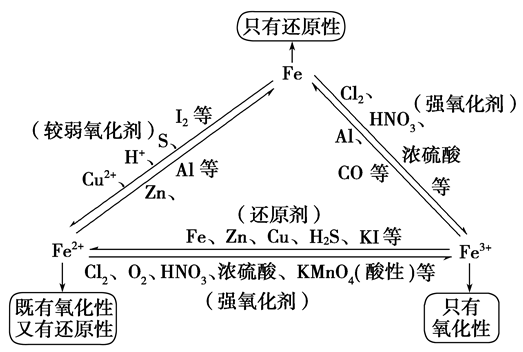
浅绿色溶液,既有氧化性性又具有还原性,主要表现还原性
(1)与氧化剂反应生成三价铁 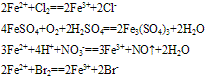
(2)与碱反应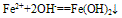
(3)Fe2+易被氧化,水溶液中易水解。亚铁盐溶液(FeCl2)在保存时加入少量铁屑以防止Fe2+被氧化,滴入少量相应的酸溶液(HCl),防止Fe2+水解。
(1)不增:不增加新的杂质
(2)不减:被提纯的物质不能减少
(3)易分:操作简便,易于分离
气体除杂的原则:
(1)不引入新的杂质
(2)不减少被净化气体的量注意的问题:
①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:
A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开
B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去
C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可
D. 加热升华法:欲除去碘中的沙子,即可用此法
E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法
F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体
G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法
H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离
K. 渗析法:欲除去胶体中的离子,可采用此法。如除去氢氧化钠胶体中的氯离子
常见物质除杂总结:
原物所含杂质除杂质试剂除杂质的方法
(1)N2(O2)-------灼热的铜丝网洗气
(2)CO2(H2S)-------硫酸铜溶液洗气
(3)CO(CO2)-------石灰水或烧碱液洗气
(4)CO2(HCl)-------饱和小苏打溶液洗气
(5)H2S(HCl)-------饱和NaHS溶液洗气
(6)SO2(HCl)-------饱和NaHSO3溶液洗气
(7)Cl2(HCl)-------饱和NaCl溶液洗气
(8)CO2(SO2)-------饱和小苏打溶液洗气
(9)碳粉(MnO2)-------浓盐酸加热后过滤
(10)MnO2(碳粉)-------加热灼烧
(11)碳粉(CuO)-------盐酸或硫酸过滤
(12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体
(13)Fe2O3(Al2O3)-------NaOH溶液过滤
(14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体
(15)SiO2(ZnO)-------盐酸过滤
(16)CuO(ZnO)-------NaOH溶液过滤
(17)BaSO4(BaCO3)-------稀硫酸过滤
(18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤
(19)NaHCO3(Na2CO3)-------通入过量CO2
(20)Na2CO3(NaHCO3)-------加热
(21)NaCl(NaHCO3)-------盐酸蒸发结晶
(22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤
(23)FeCl3(FeCl2)-------通入过量Cl2
(24)FeCl3(CuCl2)-------铁粉、Cl2过滤
(25)FeCl2(FeCl3)-------铁粉过滤
(26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析
(27)CuS(FeS)-------稀盐酸或稀硫酸过滤
(28)I2(NaCl)------升华
(29)NaCl(NH4Cl)-------加热
(30)KNO3(NaCl)-------蒸馏水重结晶
(31)乙烯(SO2、H2O)碱石灰洗气
(32)乙烷(乙烯)-------溴水洗气
(33)溴苯(溴)-------稀NaOH溶液分液
(34)硝基苯(NO2)-------稀NaOH溶液分液
(35)甲苯(苯酚)-------NaOH溶液分液
(36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏
(37)乙醇(水)-------新制生石灰蒸馏
(38)苯酚(苯)-------NaOH溶液、CO2分液
(39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液
(40)溴乙烷(乙醇)-------蒸馏水分液
(41)肥皂(甘油)-------食盐过滤
(42)葡萄糖(淀粉)-------(半透膜)渗析
与“运用铁及其化合物的知识,完成下列各题.(1)下列物质跟铁反应...”考查相似的试题有:
- 对下列实验现象的描述,不正确的是[ ]A.铁丝在氯气中燃烧产生棕黄色的烟B.蘸有浓硫酸的玻璃棒伸到集满氨气的瓶中会产生白烟...
- 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4...
- 某同学利用铁与水蒸气反应后的固体物质进行了如下实验:(1)固体溶于盐酸的化学方程式为________________;(2)试剂1的化学...
- 若把Fe3O4看成“混合氧化物”时可以写成FeO•Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4...
- 某小组取一定质量的FeSO4固体,利用下图装置进行实验。实验实验过程实现现象①通入一段时间N2,加热A中固体变为红棕色,B中有...
- 三氯化铁在印刷、照像、医药、颜料以及有机合成催化剂方面有重要的应用。三氯化铁易潮解,在100℃时发生升华。通常,工业生产...
- 下列各组物质中,物质之间通过一步反应就能实现如图所示转化关系的是( )物质编号物质转化关系abcd①FeCl2FeCl3FeCaCl2②NONO2...
- 下列除杂质的方法不可行的是[ ]A.用过量氨水除去Al3+溶液中的少量Fe3+B.将混合气体通过灼热的铜网除去N2中的少量O2C.用新...
- Na2CO3固体中混有少量NaHCO3,除去杂质的方法是_____________________,反应方程式为______________________________;NaHCO3...
- 下图表示从固体混合物中除去杂质X的两种方案,请根据方案I与方案Ⅱ指出下列说法不合理的是[ ]A.可以选用方案I除去NaCl中的I2B...