本试题 “同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:(1)已知酸性FCH2COOH>CH3COOH,试推断:①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由...” 主要考查您对溶解性
无机含氧酸分子的酸性
无机分子的立体结构
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解性
- 无机含氧酸分子的酸性
- 无机分子的立体结构
(1)相似相溶原理:极性分子易溶于极性分子溶剂中(如HCl易溶于水中),非极性分子易溶于非极性分子溶剂中(如CO2易溶于CS2中)
(2)分子结构:含有相同官能团且该官能团在分子中所占比重较大的物质能够相互溶解。如:乙醇与水互溶;戊醇不能与水互溶、与己烷能互溶。
(3)分子之间能形成氢键,会增大溶解度。
(4)溶质若能与溶剂发生反应,溶解度会增大。
影响物质溶解性的因素:
1.看溶质与水能否发生反应
溶质若能与水发生反应,则会增大溶质的溶解度,如
2.分子的极性
非极性分子构成的物质易溶于非极性溶剂,难溶于极性溶剂;极性分子构成的物质易溶于极性溶剂,难溶于非极性溶剂。如苯易溶于植物油而难溶于水; NH3、HCl易溶于水而难溶于苯。
3.氢键
溶质与溶剂分子之间若能形成分子问氢键,会增大溶质的溶解度。如NH3、HF都能与H2O形成分子间氢键,溶解度较大。
可以的分子式为HmROn,其通式可以写成(HO)mROn,也可写成ROm-nOHn,其中R称为成酸元素,无机含氧酸在水溶液中的酸强度取决于酸分子中羟基-O-H的电离程度,也可以用Pka值来衡量。酸分子羟基中的质子在电离过程中脱离氧原子,转移到水分子中的孤对电子对上,其转移的难易程度取决于成酸元素R吸引羟基氧原子电子的能力。如果成酸无素R的电负性越大,R周围的非羟基氧原子数目越多,则其酸性越强。原因是成酸元素R的电负性越大,则其偏移O的电子越少,从而减小了O原子周围的电子密度增大的趋势,使得其对质子的吸引减弱,有利于质子的转移;非羟基氧原子越多,则分子周围越易形成离域π键,这种键将成酸R原子及O原子包裹在其中,一方面增强了羟基-O-H键的极性,有利于质子的转移,其次使得整个酸基团周围的空间减小,阻碍了质子与O原子上孤对电子的结合,从而使得酸性增强。
含氧酸的酸性一般存在如下规律:
(1)同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如
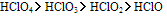
〔原因:从HClO到HClO4非羟基氧原子逐渐增多,羟基-O-H键的极性增强,质子转移程度增强,故酸性增强〕
(2)在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自上而下减弱。如

〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原子半径增大,吸引羟基氧原
子的能力依次减小,羟基-O-H键的极性依次减小,所以酸性依次减弱。〕
(3)在同一周期中,处于最高氧化态的成酸元素,其含氧酸的酸性随原子序数递增,自左至右增强。如

〔原因:同一周期中,从左至右元素的非金属性逐渐增强,成酸元素的电负性逐渐增大,吸引电子对的能力逐渐减小,电子偏向成酸元素R一方的程度增大,含氧酸分子中的氢原子的极化程度增大,所以酸性增强〕
分子中原子的空间关系是分子表现出不同的空间构型。
用价层电子对互斥理论确定分子或离子的VSEPR模型和立体构型的方法:
首先计算分子或离子中的中心原子的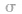 键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
键电子对数和孤电子对数,相加便得到中心原子的价层电子对数。然后由价层电子对的相互排斥,便得到含有孤电子对的VSEPR模型,再略去VSEPR模型中的中心原子的孤电子对,便可得到分子的立体构型。
1.价层电子对数的确定方法
(1) 键电子对数:由分子式确定,中心原子形成的
键电子对数:由分子式确定,中心原子形成的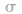 键的数目就是
键的数目就是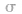 键电子对数。如
键电子对数。如 分子中的中心原子
分子中的中心原子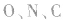 分别有2、3、4对
分别有2、3、4对 键电子对。
键电子对。
(2)孤电子对数
①分子中的中心原子上的孤电子对数
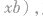 式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
式中a为中心原子的价电子数(主族元素原子的价电子就是最外层电子);x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数 (氢为l,其他原子等于“8一该原子的价电子数”)。
以 为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则
为例,a均为6,x分别为2和3,b均为2(氧原子最多能接受的电子数为2),则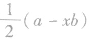 分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
分别为1和0,即SO2的中心原子上的孤电子对数为l, SO3的中心原子上没有孤电子对。
②对于阳离子,a为中心原子的价电子数减去离子的电荷数;对于阴离子,a为中心原子的价电子数加上离子的电荷数(绝对值)。x和b的计算方法及计算公式[中心原子上的孤电子对数= ]均不变。
]均不变。
2.确定分子(或离子)的VSEPR模型
根据价层电子对数和价层电子对的相互排斥,可得出分子或离子的VSEPR模型,其关系如下表。 
3.确定分子(或离子)的立体构型略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型,如上表。
(1)分子或离子中的价层电子对数分别为2、3、4,则其VSEPR模型分别为直线形、平面三角形、正四面体形或四面体形。如果价层电子对数为5,则为三角双锥形;如果为6,则为正八面体形或八面体形。
(2)如果中心原子的孤电子对数为0,则VSEPR模型(及名称)和分子或离子的立体构型(及名称)是一致的;若孤电子对数不为0,则二者不一致。
与“同族元素的同类物质的结构、性质既有相似性,也有特殊性。回...”考查相似的试题有:
- 化学家鲍林在研究含氧酸的强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是-OH)氧原子数与酸性强弱成相关性。...
- 关于下列粒子的描述不正确的是A.PH3的电子式为,其热稳定性不如NH3B.HS-的电子式为,是含有极性键的18电子的粒子C.CH2Cl2...
- 某物质化学式为NH5,常温下为固体,能与水剧烈反应放出两种气体,且在NH5中的各原子均具有稀有气体的稳定结构,则下列有关NH5...
- (三选一)【物质结构与性质】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制...
- 下列分子的空间构型为V型的是( ) A.H2O B.NH3 C.HF D.CH4
- (4分)在Na2S、KOH、CH4、Cl2、Na2O2、H2O2、NH4Cl中,只含有离子键的是__________,只含有极性键的是__________,含有非极...
- 下列物质中,与甲烷相似,都具有正四面体结构的是( ) A.CO2 B.CCl4 C.CH2Cl2 D.H2O
- 【物质结构与性质】(15分)(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示: XYZI149673...
- 同一周期的4种元素,原子半径从小到大的顺序为C
- 航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法不正确的是( )A.C2O3和CO2都属于非金属...