本试题 “下列说法中错误的是[ ]A.从1 L 1mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1B.制成0.5 L 1 mol·L-1的盐酸,需要氯化氢气体11.2L(标准状况)C.0...” 主要考查您对物质的量
物质的量浓度
阿伏加德罗常数
配制一定物质的量浓度的溶液
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量
- 物质的量浓度
- 阿伏加德罗常数
- 配制一定物质的量浓度的溶液
物质中含有一定数目粒子集体的物理量。是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度、质量、时间、电流强度、发光强度、温度、物质的量)符号:n
计算公式:物质的量(n)=粒子数(N)/阿伏加德罗常数(NA) 以物质的量为中心的各种化学常用量间的关系:n=N/NA=m/M=V/Vm=cV=ρV/M
使用物质的量注意事项:
(1)物质的量表示物质所含指定粒子的多少,物质的量是一个整体,不得简化或增添任何字。
(2)物质的量及其单位摩尔的适用范围是微观粒子,因此在使用中应指明粒子的名称。
物质的量的相关解法:
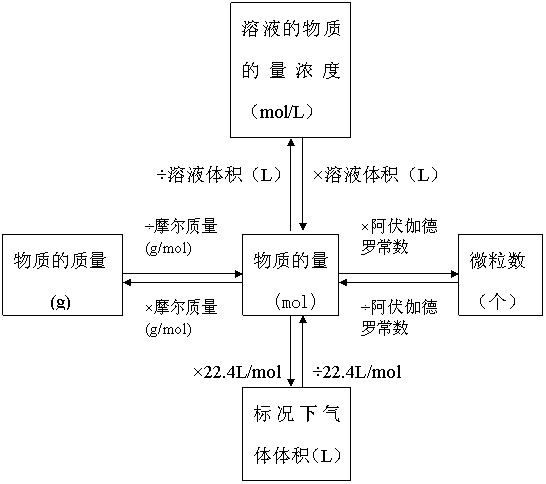
问题探究:
(1)1mol氢这种说法正确吗?如何表示1mol氢原子、1mol氢分子、1mol氢离子?
答:使用摩尔作单位时,应用化学式(符号)指明离子的种类,1mol氢的说法不正确,因其咩有指明是氢分子还是氢离子、氢原子。1mol氢原子、1mol氢分子、1mol氢离子分别表示为1molH、1molH2、1molH+。
(2)阿佛加德罗常数和6.02×1023mol-1在实际使用上有何区别?
阿佛加德罗常数是一个非常精确的数字,而6.02×1023mol-1只是阿佛加德罗常数的一个近似值。在关于概念性描述时要求非常准确,要使用阿佛加德罗常数,而在涉及计算时,则用6.02×1023mol-1进行粗略计算。二者关系类似于数学上的圆周率∏与3.14的关系。
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
物质的量浓度与质量分数(质量百分比浓度)的比较:
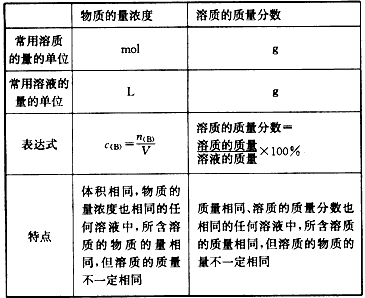
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
阿佛加德罗常数:
1mol粒子集体所含离子数与0.012kg碳12中所含的碳原子数相同,约为6.02×1023。
把1mol任何粒子的粒子数叫阿伏加德罗常数。
符号:NA,通常用6.02×1023mol-1表示
阿佛加德罗常数的单位:
阿佛加德罗常数是有单位的量,其单位是:mol-1,需特别注意。
阿佛加德罗常数的正误判断:
关于阿伏加德罗常数(NA)的考查,涉及的知识面广,灵活性强,是高考命题的热点。解答该类题目时要细心审题,特别注意题目中的关键性字词,留心“陷阱”。主要考查点如下:
1.考查“标准状况”、“常温常压”等外界条件的应用
(1)在标准状况下非气态物质:如H2O、SO3、戊烷、CHCl3、CCl4、苯、乙醇等,体积为22.4L时,其分子数不等于NA。
(2)注意给出气体体积是否在标准状况下:如11.2LH2的分子数未必是0.5NA。
(3)物质的质量、摩尔质量、微粒个数不受外界条件的影响。
2.考查物质的组成
(1)特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目:如Ne、D2O、18O2、H37Cl、—OH等。
(2)某些物质的阴阳离子个数比:如NaHSO4晶体中阴、阳离子个数比为1∶1,Na2CO3晶体中阴、阳离子个数比为1∶2。
(3)物质中所含化学键的数目:如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
(4)最简式相同的物质中的微粒数目:如NO2和N2O4,乙烯和丙烯等。
3.考察氧化还原反应中电子转移的数目
如:Na2O2、NO2与H2O的反应;Cl2与H2O、NaOH溶液、Cu或Fe的反应;电解AgNO3溶液、NaCl溶液等。
4.考查弱电解质的电离及盐的水解
如1L0.1mol/L的乙酸溶液和1L0.1mol/L的乙酸钠溶液中的CH3COO-的数目不相等且都小于0.1NA;1L0.1mol/L的NH4NO3溶液中c(NH4+)<0.1mol/L,但含氮原子总数仍为0.2NA;1molFeCl3水解生成Fe(OH)3胶粒的数目远远小于NA。
5.考查一些特殊的反应
如, 1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和
1molN2与3H2反应实际生产中得不到2molNH3,因是可逆反应;标准状况下2.24LO2和2.24LNO混合后,由于发生:2NO+O2==2NO2和![]() 两个反应,使2.24L<V<3.36L。
两个反应,使2.24L<V<3.36L。
有关NA的问题中常见的几种特殊情况:
有关NA的问题分析中易忽视如下问题而导致错误:
(1)碳原子超过4个的烃类物质、标准状况下的SO3等均不是气体,不能使用“22.4L/mol”来讨论问题。
(2)Na2O2由Na+和O22-构成,而不是由Na+和O2-构成,阴阳离子个数比为1:2而不是1:1.
(3)SiO2结构中只有原子无分子,1molSiO2中含有共价键数为4NA
(1)仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管
(2)原理:c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
(3)步骤:
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,用玻璃棒搅拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2~3次,并倒入容量瓶中。
第六步:定容:倒水至刻度线1~2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签。
(4)误差分析:
①计算是否准确
若计算的溶质质量(或体积)偏大,则所配制的溶液浓度也偏大;反之浓度偏小。
如配制一定浓度的CuSO4溶液,把硫酸铜的质量误认为硫酸铜晶体的质量,导致计算值偏小,造成所配溶液浓度偏小。
②称、量是否无误
如称量NaOH固体在纸上或称量时间过长,会导致NaOH部分潮解甚至变质,有少量NaOH黏附在纸上,造成所配溶液浓度偏低。
量取液体溶质时,俯视或仰视量筒读数,会导致所取溶质的量偏少或偏多,造成所配溶液浓度偏小或偏大。
使用量筒量取液体溶质后再用蒸馏水冲洗量筒,把洗涤液也转入烧杯稀释,或用移液管将液体溶质移入烧杯中后把尖嘴处的残留液也吹入烧杯中。在制造量筒、移液管及滴定管时,已经把仪器内壁或尖嘴处的残留量扣除,所以上述操作均使溶质偏多,造成所配溶液浓度偏大。
③称量时天平未调零
结果不能确定。若此时天平重心偏左,则出称量值偏小,所配溶液的浓度也偏小;若重心偏小,则结果恰好相反。
④称量时托盘天平的砝码生锈
砝码由于生锈而使质量变大,导致称量值偏大,所配溶液的浓度偏高。
⑤操作中溶质有无损失
在溶液配制过程中,若溶质有损失,会使所配溶液浓度偏低。如:⑴溶解(或稀释)溶质,搅拌时有少量液体溅出;⑵未洗涤烧杯或玻璃棒;⑶洗涤液未转入容量瓶;⑷转移洗涤液时有少量液体溅出容量瓶。
影响溶液体积V的操作有:
①定容时不慎加水超过容量瓶的刻度线,再用胶头滴管吸出,使液面重新达到刻度线。当液面超过刻度线时,V偏大使溶液浓度CB已变小,无论是否取出都无法使溶液恢复,只有重新配制。
②定容后盖上瓶塞,摇匀后发现液面低于刻度线,再滴加蒸馏水使液面重新达到刻度线。定容时由于少量溶液粘在瓶颈处没有回流,使液面偏低但溶液浓度未变,若再加水,则使V偏大,cB偏小。
③定容时仰视或俯视
定容时仰视,则液面高于刻度线,V偏大,cB偏小;俯视时液面低于刻度线,V偏小,cB偏大。
④移液或定容时玻璃棒下端放在容量瓶刻度线之上
会导致V偏大,cB偏小。
⑤溶液未冷却至室温即转移入容量瓶
溶解或稀释过程常伴有热效应而使溶液温度升高或降低。容量瓶的使用温度为室温(20℃),若定容时溶液温度高于室温,会使所配溶液浓度偏高;反之浓度偏低。
与“下列说法中错误的是[ ]A.从1 L 1mol·L-1的NaCl溶液中取出10 ...”考查相似的试题有:
- NA表示阿伏加德罗常数,下列说法中正确的是A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NAB.2 g H2所含有的原子数...
- 设NA代表阿伏加德罗常数的数值,则下列说法正确的是A.1.8 g D2O含有NA个中子B.用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体...
- (8分)标准状况下,①4g氢气、②33.6L甲烷(CH4)、③9.03×1023个水分子中,含分子数最多的是(填写序号,下同) ,含原子数最...
- 下列说法正确的是A.物质的量是一种国际基本物理量B.标准状况下气体摩尔体积约为22.4LC.1mol氧的质量为16gD.在同温同压下...
- NA表示阿伏加德罗常数,下列叙述正确的是A.常温下,9g H2O中含NA个O–H键B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子C.常...
- V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为[ ]A.56m/V mol/LB.3m/56V mol/LC.m/56V mol/LD.3m/112V...
- 用NA表示阿伏加德罗常数的值,下到叙述正确的是( )A.常温下,4.6gNa和足量的O2完全反应失去电子数为0.2NAB.常温常压下,1...
- NA表示阿伏伽德罗常数,以下说法不正确的是( )A.在标准状况下,11.2L以任意比例混合的H2S和SO2混合气体中含气体的分子数远...
- 右图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 1mol•L-1的稀盐酸.可供选用的...
- 下列有关实验原理或实验操作正确的是 [ ]A.用水湿润pH试纸测量某溶液的pHB.用量筒量取20mol·L-1H2SO4溶液于烧杯中,加水80mL...