本试题 “下列图示与对应的叙述相符的是( )A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反...” 主要考查您对溶解度
影响化学反应速率的因素
化学反应的限度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解度
- 影响化学反应速率的因素
- 化学反应的限度
溶解度:
(1)固体物质的溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,单位是g,符号用S表示。
表达式: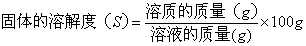
(2)气体的溶解度定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时气体的体积。
溶解度曲线:
- 溶解度曲线由于固体物质的溶解度随温度变化而变化,这种变化可以用溶解度曲线来表示。我们用纵坐标表示溶解度,横坐标表示温度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。
- 溶解度曲线的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
溶解度的影响因素:
- 固体物质溶解度的影响因素:溶质,溶剂的种类,温度
- 气体物质溶解度的影响因素:溶质,溶剂的种类,温度,压强
溶解度与温度的关系:
(1)固体物质的溶解度一般随温度的升高而增大,个别物质反常,如Ca(OH)2。
(2)气体物质的溶解度,一般随温度升高而减小,随压强增大而增大。常见的可溶性气体(常温、常压时的体积数):NH3 (700),HCl(0℃时500),HBr、HI亦易溶,SO2(40),C12 (2).H2S(2.6),CO2(1)。难溶气体:H2、CO、NO。有机物中:HCHO易溶,C2H2微溶,CH4、C2H4难溶。
a.大部分固体物质的溶解度随温度的升高而增大,如KNO3、NaNO3等。
b.少数固体物质的溶解度受温度影响很小,如 NaCl。
c.极少数固体物质的溶解度随温度的升高而减小,如 Ca(OH)2
饱和溶液与不饱和溶液、过饱和溶液:
过饱和溶液:一定温度、压力下,当溶液中溶质的浓度已超过该温度、压力下溶质的溶解度,而溶质仍不析出的现象叫过饱和现象,此时的溶液称为过饱和溶液。
饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液叫做这种溶质的不饱和溶液。
溶解度曲线:

溶解度曲线的意义:
①表示同一种物质在不同温度时的溶解度;
②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;
③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;
④根据溶解度曲线能进行有关的计算。
溶解度曲线变化规律:
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如硝酸钾。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如氯化钠。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如氢氧化钙。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
溶解度曲线的应用:
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。

溶解度曲线上的点的意义:
①溶解度曲线上的点表示物质在该点所示温度下的溶解度,溶液所处的状态是饱和溶液。
②溶解度曲线下面的面积上的点,表示溶液所处的状态是不饱和状态,依其数据配制的溶液为对应湿度时的不饱和溶液。
③溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有剩余。
④两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的溶解度相等。
有关溶解度的计算:
某温度下,
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
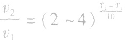
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
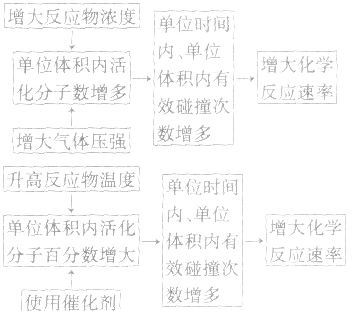
3.外因对化学反应速率影响的微观解释
研究可逆反应所能达到的最大程度。也就是化学平衡状态。
达到反应限度的判断:
(1)v正=v逆
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的、前后化学计量数改变的可逆反应,压强、平均相对分子量保持不变。
(4)对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化
(5)对于同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等
与“下列图示与对应的叙述相符的是( )A.图1表示某吸热反应分别...”考查相似的试题有:
- 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回...
- 将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是( )A.硫酸铜的...
- 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO24ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐...
- 保持相同的温度,可逆反应2A(g)+B(g)2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较[ ]A...
- 可逆反应mA(g)+nB(g)⇌pC(g)+qD(g)的v-t图象如图甲,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如...
- 下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断A.正反应是吸热...
- 下列条件的改变,一定会同时影响化学反应速率和化学平衡的是[ ]A.浓度B.压强C.温度D.催化剂
- (10分)利用催化剂可使NO和CO发生反应:2NO(g)+2C0(g)2CO2(g)+N2(g) △H
- 某课外兴趣小组对H2O2的分解速率做了如下实验探究.(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数...
- 对于可逆反应,A2(g)+3B2(g)⇌2AB3(g)△H<0,下列图象不正确的是( )A.B.C.D.