本试题 “学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分...” 主要考查您对影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学反应速率的因素
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为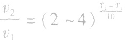
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
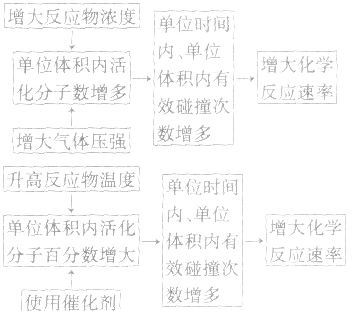
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
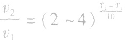
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了...”考查相似的试题有:
- 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳。对此反应,下列叙述中正确的是[ ]A....
- 有X、Y、Z三种物质.常温下分别用Y或Z与X混合时,反应速率几乎相同的是( )选项XYZ①2mL 5%H2O2 溶液1mL 1mol•L-1CuSO4溶液1m...
- 对于达到平衡的可逆反应:X+Y⇌W+Z,其他条件不变时,增大压强,正、逆反应速率(υ)变化的情况如图所示.下列对X、Y、W、Z四...
- 如图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )A.升高温度,同时加压B...
- (1)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气产生的速率变化情况如下图所示。其中t1~t2速率变化的主要原因是__...
- 在相同体积的密闭容器中,按照如下条件充入反应混合物,开始反应时速率最小的是( )A.400℃10mol SO2 和5molO2B.400℃20mol ...
- 影响化学反应速率的因素很多,下列措施能加快化学反应速率的是[ ]A.升高温度B.降低温度C.减小压强D.降低反应物浓度
- 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。(1)将一定量纯净的氨基甲酸铵置于...
- 四个体积相同的密闭容器中,在一定条件下发生反应:反应开始时,反应速率最大的是 容器温度N2(mol)H2(mol)催化剂A50026有B5...
- 下列四个试管中,CaCO3与稀盐酸反应产生CO2的反应速率最大的是( )试管温度盐酸浓度碳酸钙状态A20℃0.5mol•L-1块状B40℃0.5mol...