本试题 “盐酸和醋酸是生产、生活和化学实验中常用的酸。请回答:(1)人的胃液中含有盐酸,经测定某人胃液的pH=2,则其中的c(H+)=______mol/L。(2)食醋常用于食品...” 主要考查您对电离方程式
强酸和弱酸的比较
溶液的酸碱性
盐水解的影响因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电离方程式
- 强酸和弱酸的比较
- 溶液的酸碱性
- 盐水解的影响因素
表示电解质电离的式子。强电解质电离用“=”,弱电解质电离用“
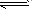 ” 。
” 。.
电离方程式的书写:
1.强电解质的电离用“ ”,弱电解质的电离用 “
”,弱电解质的电离用 “ ”。
”。
2.多元弱酸分步电离,分步持写电离方程式,一般只写第一步;多元弱碱也是分步电离的,但可按一步完全电离写出。例如:
氧硫酸: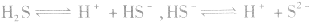
氢氧化铁:
3.强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根不完全电离。例如: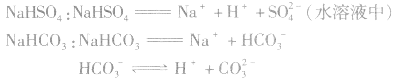
说明:在熔融状态时,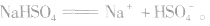
4.某些复盐能完全电离。例如:
强酸与弱酸(或强碱与弱碱)的比较:
1.强酸与弱酸(或强碱与弱碱)由于电离程度的不同,在很多方面表现出不同的性质 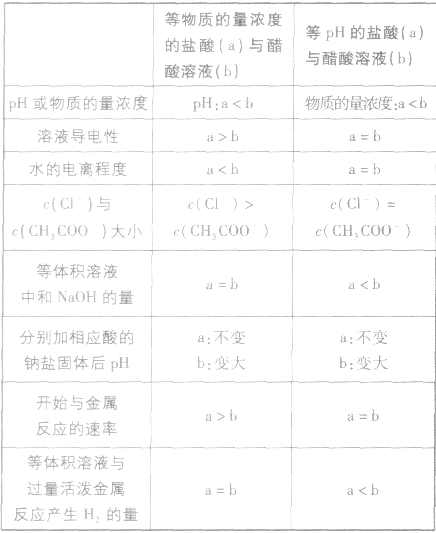
2.稀释时pH变化特点比较如下图:a、b分别为体积相等、pH相等的NaOH溶液和氨水的稀释曲线线;c、d分别为体积相等、pH相等的盐酸和醋酸溶液的稀释曲线,请体会图中的两层含义: 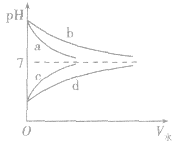
(1)加水稀释相同倍数后的pH大小:氨水>NaOH溶液,盐酸>醋酸溶液。若稀释10n倍,盐酸、Na0H溶液pH变化n个单位,而氨水与醋酸溶液pH变化小到 n个单位。
(2)稀释后的pH仍然相等,则加水量的大小:氨水 >NaOH溶液,醋酸溶液>盐酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
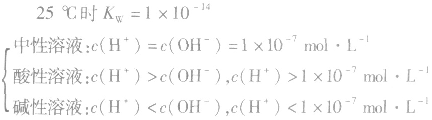
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
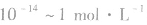 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: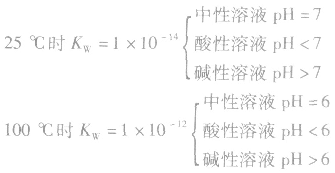
主要因素是盐本身的性质,组成的盐的酸根对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,另外还受温度、浓度及外加酸碱等因素的影响。
(1)温度:盐的水解是吸热反应,因此升高温度水解程度增大;
(2)浓度:盐的浓度越小,水解程度越大,但溶液的酸碱性一般越弱;
(3)外加酸碱:外加酸碱能促进或抑制盐的水解,使盐的水解程度降低,但由于酸(或碱)的加入,使溶液的酸(碱性)增强。
例如: 外界条件对
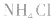 水解平衡
水解平衡
 的影响
的影响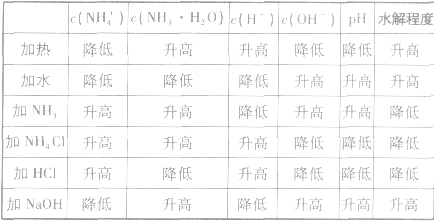
(4)能水解的阳离子与能水解的阴离子混合,会相互促进水解。常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应:阳离子:Fe3+、Al3+;阴离子:CO32-、HCO3-、S2-、HS-、AlO2-、SO32-、HSO3-等。
(5)Fe3+与S2-、HS-、SO32-、HSO3-等还原性离子发生氧化还原反应,而不是发生双水解反应。
(6)HCO3-与AlO2-在溶液中也不能共存,可发生反应产生白色沉淀,但不是由于双水解反应,而是:
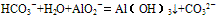
盐类水解程度大小比较规律:
1.盐水解生成的弱酸(或弱碱)越弱,水解程度越大。常据此判断弱酸(或弱碱)的相对强弱:如等浓度的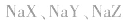 三种盐溶液,pH依次增大,则弱酸根离子
三种盐溶液,pH依次增大,则弱酸根离子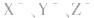 的水解程度依次增大,所以酸性HX>HY>HZ。
的水解程度依次增大,所以酸性HX>HY>HZ。
2.相同条件下:正盐>相应酸式盐。如水解程度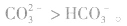
3.相互促进水解的盐>单水解的盐>相互抑制水解的盐。如水解程度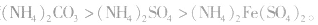
与“盐酸和醋酸是生产、生活和化学实验中常用的酸。请回答:(1)...”考查相似的试题有:
- 以下是4位同学写出的错误的电离方程式和其他同学给出的相关点评。你认为点评错误的是[ ]A.Al2(SO4)3=Al3++SO42-,此式错误主...
- 下列有关实验操作、现象和解释或结论都正确的是[ ]实验操作 现象解释或结论A.在试管中的无色溶液中滴加稀NaOH溶液,将湿润的...
- 室温时,下列混合溶液的pH一定小于7的是[ ]A.pH=3的盐酸和pH=11的氨水等体积混合B.pH=3的盐酸和pH=11的氢氧化钡溶液等...
- (12分)镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。已知:①镧是较活泼金属,在空气中易被氧化;②...
- 已知Cl2、Al2S3、CaC2、C2H5Br、CH3COOCH3等物质的均能与水发生反应,反应可视为各物质和水均分别离解成两部分,然后再两两重...
- 取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25oC),则下列说法(或关...
- (16分)广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含...
- 下列溶液中各微粒的浓度关系或说法错误的是A.0.1 mol•L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)B.c(NH4+)相等的(N...
- 下列溶液加热蒸干后,能析出溶质固体的是( )A.AlCl3B.NH4HCO3C.KHCO3D.Fe2(SO4)3
- 常温下有A、B、C、D分别是CH3COONa、NH4Cl、Na2SO4和盐酸四种溶液中的一种,已知A、B溶液的pH相同,A、C溶液中水的电离程度相...