本试题 “下列关于晶体的说法正确的组合是( )①分子晶体中都存在共价键②在晶体中只要有阳离子就一定有阴离子③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低④离...” 主要考查您对晶格能
分子晶体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 晶格能
- 分子晶体
晶格能:
1.定义气态离子形成1mol离子晶体释放的能量。晶格能通常取正值,单位为kJ/mol。
2.影响晶格能大小的因素
(1)离子的电荷:离子所带的电荷越多,晶格能越大。
(2)离子的半径:离子的半径越小,晶格能越大。
3.晶格能的作用
晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。同时,晶格能的大小亦影响岩浆晶出的先后次序,晶格能越大,岩浆中的矿物越易结晶析出。
分子晶体:
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 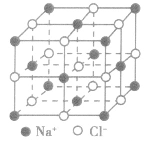 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 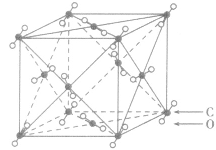 |
| 金刚石晶体 |  |
| SiO2晶体 | 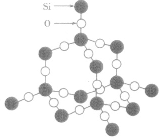 |
| 石墨晶体 (混合晶体) | 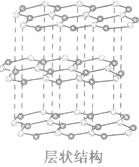 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
发现相似题
与“下列关于晶体的说法正确的组合是( )①分子晶体中都存在共价...”考查相似的试题有:
- Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能...
- 下列八种晶体:A、铝 B、金刚石 C、氧化镁 D、冰醋酸 E、氩晶体 F、硫酸铵 G、水晶 H、白磷(1)属于原子晶体的化合物是_...
- 下列叙述中正确的是[ ]A.某非金属元素从游离态变成化合态时,该元素一定被还原B.气态氢化物的稳定性:HF>HCl,是因为H-F...
- 干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔点差别很大的原因是[ ]A.二氧化硅的相对分子质量大于二氧化碳的相对...
- 有关晶体的下列说法中不正确的是[ ]A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水...
- 根据下列性质判断所描述的物质可能属于分子晶体的是( ) A.熔点1070℃,易溶于水,水溶液能导电 B.熔点10.31℃,液态不导电...
- S2Cl2是橙黄色液体,少量泄漏会产生室息性气味的气体,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2...
- 四种短周期元素A、B、C、D的性质或结构信息如下:信息①原子半径大小:A>B>C>D信息②四种元素之间形成的某三种分子的比例模型及...
- 下列关于晶体的说法正确的组合是[ ]①分子晶体常温下都呈液态或气态;②在晶体中只要有阴离子就一定有阳离子;③金刚石、SiO2、N...
- 下列有关晶体的叙述中,错误的是[ ]A.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏B.白磷晶体中,结构...