本试题 “某同学设计了一种用电解法制取Fe(OH)2的试验装置如图.通电后,溶液中产生白色沉淀,且较长时间内不变色,下列说法中正确的是( )A.电源中a为正极,b为负...” 主要考查您对氢氧化亚铁
氢氧化铁
电解池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氢氧化亚铁
- 氢氧化铁
- 电解池原理
氢氧化亚铁:
化学式为Fe(OH)2,白色固体,难溶于水,碱性较弱,可与常见酸反应;在空气中易被氧化,白色→灰绿色→红褐色。反应方程式如下:
(1)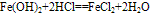
(2)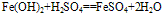
(3)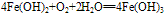
氢氧化亚铁的性质:
氢氧化亚铁极易被氧化,水中的溶解氧就可以把它氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2=△=2Fe2O3+4H2O
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
氢氧化亚铁的制备:
因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3
方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
【典例】 Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__________________________________________________________ ________________________________________________________
Ⅱ.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。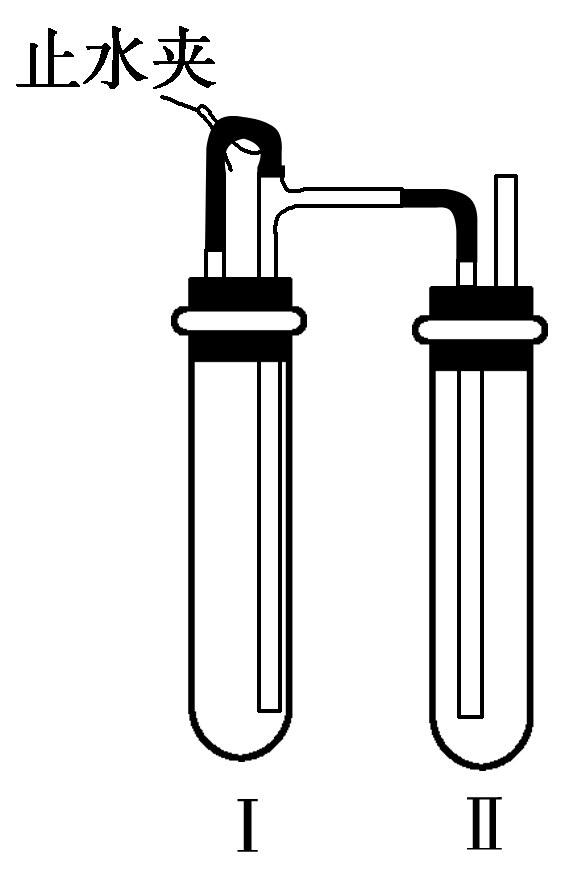
(1)在试管Ⅰ中加入的试剂是________。
(2)在试管Ⅱ中加入的试剂是________。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,理由是_________________________________________________________________。
【答案】:Ⅰ.(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2而被氧化 Ⅱ.(1)稀H2SO4和铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,故外界O2不易进入
2、电化学制备
【典例】 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为_______,其电极反应式为_______________。
②电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是______________,在加入苯之前,对d溶液进行加热处理的目的是___________。
④为了在短时间内看到白色沉淀,可以采取的措施是____________________。
A.改用稀硫酸做电解液 B.适当增大电源电压 C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________。
【答案】:①Fe;Fe-2e-=Fe2+ ②C;B ③隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成的Fe(OH)2在溶液中氧化 ④B、C ⑤白色沉淀迅速变成灰绿色,最后变成红褐色
氢氧化铁:
红褐色固体,难溶于水,易与酸反应;加热可分解生成氧化铁。反应方程式如下:
(1)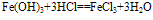
(2)
(3)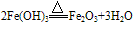
氢氧化铁胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


与“某同学设计了一种用电解法制取Fe(OH)2的试验装置如图.通电...”考查相似的试题有:
- Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:______为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeS...
- 用含少量铁的氧化物的氧化铜制取氯化铜晶体CuCl2xH2O.有如图1操作:已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2...
- 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可...
- 某电解池内盛有某电解质溶液,插入两根电极,通电后欲达到下列要求:①阳极质量不变②阴极质量增加③电解液pH变小。则可选用的电...
- 如图a、b、c、d均为石墨电极,通电进行电解。下列说法不正确的是 A.甲中a电极反应式为4OH--4e-=O2↑+2H2OB.当b极有64gCu析...
- LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:电池的正极材料是LiFePO4,负极材料是石墨...
- 把分别盛有熔融的KCl、MgCl2、Al2O3的三个电解槽串联,在一一定条件下通电一段时间后,析出K.Mg.Al的物质的量之比为 ( )A...
- 在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用[ ]A.NaOHB.HClC.NaClD.CuSO4
- 下图是电解CuCl2溶液的装置,其中c、d 为石墨电极。则下列有关的判断正确的是[ ]A.a为负极、b为正极B.a为阳极、b为阴极C....
- 电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( )A.电解时以硫酸铜溶液作电解液,精铜作阳极B.粗铜与电源负极...