本试题 “下列文字表述与反应方程式对应且正确的是[ ]A.实验室用液溴和苯在催化剂作用下制溴苯:B.用醋酸除去水垢:CaCO3+ 2H+==Ca2++ H2O + CO2↑C.钢铁的吸氧腐蚀...” 主要考查您对离子方程式
原电池电极反应式的书写
有机反应方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子方程式
- 原电池电极反应式的书写
- 有机反应方程式
用实际参加反应的离子符号表示离子反应的式子。
离子方程式书写规则:
①写:写出化学反应方程式
②拆:把易溶于水、易电离的物质写成离子形式,难容难电离的物质及气体等仍用化学式表示
③删:删去方程式两边不参加反应的离子
④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
离子方程式书写及正误的判断方法:
①判断反应是否在水溶液中进行
因为电解质在水溶液中可以电离为自由移动的离子,在这种条件下才能发生离子反应。
②判断反应能否发生。
如果反应不能发生,当然也就没有离子方程式可言。
③判断反应物、生成物是否正确。
④判断质量和电荷是否守恒。
离子方程式不仅要质量守恒,而且反应前后各离子所带电荷总数必须相等。
⑤判断氧化物、难溶物、气体、单质、难电离的弱酸、弱碱、水是否写成了分子形式,而易电离的物质是否写成离子形式。
⑥判断连接符号“=”和“
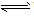 ”及状态符号“↑”和“↓”运用是否正确。
”及状态符号“↑”和“↓”运用是否正确。 强电解质的电离、不可逆反应、双水解反应用“=”;弱电解质电离、可逆反应、水解反应用“
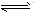 ”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。
”。复分解反应、水解反应生成的难溶物用“↓”,气体用“↑”;单水解反应生成的难溶物不用“↓”,气体不用“↑”。 ⑦判断微溶物的处理是否正确。
微溶物做反应物时,一般用离子形式,做生成物时一般用分子式。
⑧判断反应物的滴加顺序与方程式中生成物是否一致。
如:把碳酸钠溶液滴加到盐酸溶液中,和把盐酸滴加到碳酸钠溶液中反应产物是不同的。
⑨判断反应物的相对量与产物是否一致。
有些反应因反应物的量不同会生成不同的产物。如:CO2、SO2、H2S等气体与碱溶液反应时,若气体少量,则生成正盐;若气体过量,则生成酸式盐。
⑩判断电解质在写成离子形式时阴阳离子个数比是否合理。
如Ba(OH)2溶液和稀H2SO4反应的离子方程式往往错误写成:
 ,正确为:
,正确为: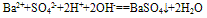
书写与量有关的离子方程式:
基本方法是:把物质的量少的物质的系数定为1,其他物质按最大量消耗。
1.因滴加顺序不同造成连续反应
- HCl与Na2CO3
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- HCl与NaAlO2
向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写 (1)CO32-+H+==HCO3- (2)HCO3-+H+==CO2↑+H2O
若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成 CO32-+2H+==CO2↑+H2O
若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为: CO32-+H+==HCO3-
- AlCl3与NaOH
向AlCl3溶液中滴入NaOH溶液至过量,其离子反应分步写 (1)Al3++3OH-==Al(OH)3↓ (2)Al(OH)3+OH-==AlO2-+2H2O
若向NaOH溶液中加入少量AlCl3溶液,其离子反应一步完成 Al3++4OH-==AlO2-+2H2O
若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为: Al3++3OH-==Al(OH)3↓
- AgNO3与NH3·H2O
向AgNO3溶液中滴入稀NH3·H2O至过量,其离子反应分步写(1) Ag++NH3·H2O==AgOH↓+NH4+ (2)AgOH+2NH3·H2O==Ag(NH3)2++OH-+2H2O
若向NH3·H2O溶液中加入少量AgNO3,其离子反应一步完成 Ag++3NH3·H2O==Ag(NH3)2++OH-+NH4++2H2O
若向足量AgNO3溶液中滴入少量NH3·H2O,其离子方程式为:Ag++NH3·H2O==AgOH↓+NH4+
- CO2与NaOH
向NaOH溶液中通人CO2气体至过量,其离子反应分步写 (1)2OH-+CO2==CO32-+H2O (2)CO32-+CO2+H2O==2HCO3-
若向足量NaOH溶液中通人少量CO2气体,其离子方程式为: 2OH-+CO2==CO32-+H2O
若向NaOH溶液中通人过量CO2气体,其离子反应一步完成 OH-+CO2==HCO3-
2.过量型:
向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 OH-+Ca2++HCO3-==H2O+CaCO3↓
向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32-
Fe与HNO3 :铁过量时:Fe+4HNO3==Fe(NO3)3+NO↑+2H2O
铁不足时:3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
3.定量型:
因还原性I->Fe2+>Br-,所以在FeI2或者FeBr2中通入一定量的Cl2,发生不同的离子反应,依次为:
(1)2I-+Cl2==2Cl-+I2(2)2Fe2++Cl2==2Fe3++2Cl-(3)2Br-+Cl2==2Cl-+Br2
4.目标型
向明矾溶液逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全 Al3++SO42-+Ba2++4OH-==AlO2-+2BaSO4↓+2H2O
向明矾溶液逐滴滴加Ba(OH)2溶液至铝离子刚好沉淀完全 Al3+SO42-+Ba2++3OH-==Al(OH)3↓+2BaSO4↓
(1)以铜锌原电池为例:
负极(Zn):Zn-2e-=Zn2+
正极(Cu):2H++2e-=H2↑
(2)正负极反应式的书写技巧:
①先确定原电池的正负极,在两极的反应物上标出相同数目的电子得失。
②根据物质放电后生成物的组成和电解质溶液中存在的离子,找到电极反应中还需要的其它离子。此时要注意溶液的酸碱性,从而判断应该是H+、OH-还是H2O参与了反应。因Zn反应后生成了Zn(OH)2,而KOH为电解质,可知负极上OH-参与了反应。MnO2生成了MnO(OH),即增加了氢元素,可知正极上有水参与了反应。
③根据电子守恒和电荷守恒写出电极反应式,即要注意配平和物质的正确书写形式,应按照离子方程式的书写要求进行。②中反应的电极反应式为:
负极:Zn+2OH--2e-=Zn(OH)2 正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
(若只要求写正极的反应式,也可以写成MnO2+H2O+e-=MnO(OH)+OH-)
原电池总反应式的书写:将正负电极反应相加,即为原电池总反应式。
原电池正、负极的判断方法:
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法有以下几种。
1.由组成原电池的两极材料判断一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断在外电路,电流由正檄流向负极;电子由负极流向正极
3.根据原电池里电解质溶液中离子的定向移动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
4.根据原电池两极发生的变化来判断原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
5.X极增重或减轻工作后,X极质量增加,说明X极有物质析出,X 极为正极:反之,X极质量减少,说明X极金属溶解,X 极为负极
6.X极有气泡冒出工作后,x极上有气泡冒出,一般是发生了析出H,的电极反应,说明x极为正极。
7.X极附近pH的变化析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。
8.特例在判断金属活泼性的规律中,有一条为“当两种金属构成原电池时,活泼金属作负极,不活泼金属作正极”,但这条规律也有例外情况,如Mg和Al为原电池的两极,KOH为电解质溶液时,虽然Mg比Al活泼,但因Mg不和KOH反应,所以Mg作原电池的正极等。
(1)有机反应方程式中有机物写结构简式。
在书写有机物结构简式时,注意:碳只能形成四个共价键,不能少写或多写氢。
例新戊烷(CH3)4C,不能写成(CH2)4C或(CH3)4CH2。
(2)一些基团的连接方式要即正确又合乎习惯,不产生歧义。
例醛基-CHO,不能写成CHO-也不能写成-COH(写成此种形式,可能会误认为碳原子和氧原子之间是单键)。另外常见官能团-C6H5、-OH、-NO、-NH2、-COOH等不能写成C6H5-、OH-、NO2-、NH2-、COOH-等,尤其注意官能团写在物质左侧的。
(3)注意有机反应的条件,反应物和产物中间用“→”连接。
有机反应方程式举例:
一、烷烃、烯烃、炔烃
1. 甲烷的实验室制法C2H5OH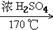 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2. 甲烷燃烧CH4+2O2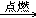 CO2+2H2O
CO2+2H2O
3. 甲烷与氯气CH4+Cl2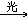 CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2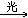 CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2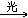 CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2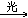 CCl4+HCl
CCl4+HCl
4. 甲烷隔绝空气时高温分解CH4 C+2H2
C+2H2
5. 丁烷的裂解(两个方程式)C4H10 CH4+C3H6
CH4+C3H6
C4H10 C2H4+C2H6
C2H4+C2H6
6. 乙烯的实验室制法CH3CH2OH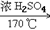 CH2=CH2↑+H2O
CH2=CH2↑+H2O
7. 乙烯燃烧C2H4+3O2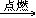 2CO2+2H2O
2CO2+2H2O
8. 乙烯使溴水褪色CH2=CH2+Br2→CH2Br─CH2Br
9. 乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH
C2H5OH
12. 乙烯的加聚
13. 乙烯与丙烯1:1加聚
14. 异戊二烯聚合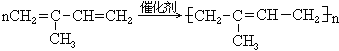
15. 苯乙烯与异戊二烯1:1加聚
16. 乙炔的实验室制法CaC2+2H2O→CH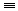 CH↑+Ca(OH)2
CH↑+Ca(OH)2
17. 乙炔与足量氢气反应CH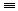 CH+2H2
CH+2H2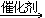 CH3-CH3
CH3-CH3
18. 乙炔的聚合
19. 由乙炔制备聚氯乙烯CH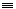 CH+HCl
CH+HCl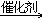 CH2=CHCl
CH2=CHCl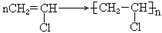
二、苯及其同系物
20. 苯燃烧2C6H6+15O2 12CO2+6H2O
12CO2+6H2O
21. 苯与液溴反应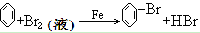
22. 甲苯的硝化反应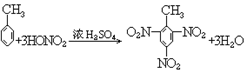
23. 苯与氢气反应
25. 甲苯与浓硝酸、浓硫酸反应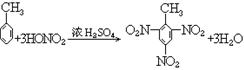
三、卤代烃的性质
26. 溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
27. 溴乙烷的水解反应CH3-CH2-Br+NaOH CH3-CH2-OH+NaBr
CH3-CH2-OH+NaBr
28. 氯苯与氢氧化钠水溶液反应
四、醇的性质
29. 乙醇燃烧C2H5OH+3O2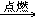 2CO2+3H2O
2CO2+3H2O
30. 乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑
31. 乙醇的催化氧化2C2H5OH+O2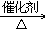 2CH3CHO+2H2O
2CH3CHO+2H2O
32. 乙醇与浓硫酸反应(两个方程式)CH3CH2OH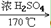 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O
CH3─CH2─O─CH2─CH3+H2O
33. 乙醇与乙酸反应C2H5OH+CH3COOH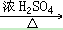 CH3COOC2H5+H2O
CH3COOC2H5+H2O
34. 乙二醇与钠反应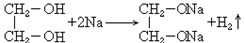
35. 甘油与硝酸反应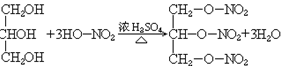
五、酚的性质
36. 苯酚与钠反应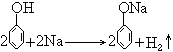
37. 苯酚与氢氧化钠反应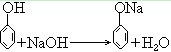
38. 苯酚与浓溴水反应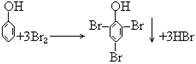
39. 苯酚钠与二氧化碳反应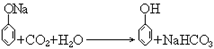
40. 苯酚与甲醛缩聚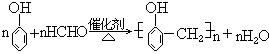
与“下列文字表述与反应方程式对应且正确的是[ ]A.实验室用液溴...”考查相似的试题有:
- 根据下图,可判断出下列离子方程式中错误的是 A.B.C.D.
- 下列离子方程式书写不正确的是( )A.常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2OB.AlCl3溶液中加入足量的氨水:Al3+...
- 下列离子方程式中正确的是A.氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2= HCO3-B.亚硫酸氢铵溶液与足量氢氧化钠溶液反应 H...
- 下列反应的离子反应方程式正确的是:A.实验室用氨水、氯化铁溶液制备少量Fe(OH)3:Fe3++ 3OH-==Fe(OH)3↓B.Ba(OH)2和MgSO4...
- 下列反应的离子方程式书写正确的是A.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑B.少量CO2气体通入到澄清石灰水中: CO2+2OH-+...
- 用等体积的0.1mol/L的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液的SO42-完全沉淀,则三种硫酸盐的...
- 下列离子方程式的书写正确的是 ( )A.NaHCO3溶液与NaOH溶液反应: OH-+ HCO3-= CO2↑+ H2OB.向AlCl3溶液中加入过量的氨水...
- 下列反应的离子方程式书写正确的是A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32-= CaCO3↓B.氢氧化钡溶液与硫酸铜溶液反应:Ba...
- 下列文字表述与反应方程式对应且正确的是( )A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓B.用醋酸除去水垢:...
- 下列离子方程式不正确的是 A.氢氧化钡溶液跟盐酸反应:OH-+H+=H2OB.三氯化铁溶液跟过量氨水反应:Fe3++3NH3·H2O=Fe(OH)3↓+3...