本试题 “1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃-棒碳,它是分...” 主要考查您对碳单质及化合物
极性键、非极性键
炔烃的通性
同系物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 碳单质及化合物
- 极性键、非极性键
- 炔烃的通性
- 同系物
碳:
①元素符号:C
②原子结构示意图: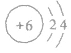
③电子式: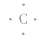
④周期表中位置:第二周期ⅣA族
⑤含量与存在:在地壳中的含量为0.087%,在自然界中既有游离态,又有化合态
⑥同素异形体:金刚石、石墨、C60、活性炭
碳(活性炭):
①金刚石:纯净的金刚石是无色透明、正八面体形状的固体,硬度大,熔点高,不导电,不溶于水
石墨:深灰色的鳞片状固体,硬度小,质软,有滑腻感,熔点高,具有导电性
活性炭:黑色粉末状或颗粒状的无定形碳,疏松多孔,有吸附性
②碳的化学性质:
a.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
b.可燃性:氧气充足的条件下:C+O2 CO2 氧气不充分的条件下:2C+O2
CO2 氧气不充分的条件下:2C+O2 2CO
2CO
c.还原性:
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
二氧化碳:
①物理性质:常温下,二氧化碳是一种无色无味的气体,密度比空气大,能溶于水。固态的二氧化碳叫做干冰。
②化学性质:
a.一般情况下,二氧化碳不能燃烧,也不支持燃烧,不供给呼吸,因此当我们进入干枯的深井,深洞或久未开启的菜窖时,应先做一个灯火实验,以防止二氧化碳浓度过高而造成危险
b.二氧化碳和水反应生成碳酸,使紫色石蕊试液变红:CO2+H2O===H2CO3,碳酸不稳定,很容易分解成水和二氧化碳,所以红色石蕊试液又变回紫色:H2CO3===H2O+CO2↑
c.二氧化碳和石灰水反应:Ca(OH)2+CO2====CaCO3↓+H2O
d.二氧化碳可促进植物的光合作用:6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
③用途:
a.二氧化碳不支持燃烧,不能燃烧,比空气重,可用于灭火
b.干冰升华时吸收大量的热,可用它做制冷剂或人工降雨
c.工业制纯碱和尿素,是一种重要的化工原料 d.植物光合作用,绿色植物吸收太阳能,利用二氧化碳和水,合成有机物放出氧气。
一氧化碳:
①物理性质:通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
②化学性质
a.可燃性:2CO+O2 2CO2
2CO2
b.还原性:一氧化碳还原氧化铜:CO+CuO Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3
Cu+CO2 一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4
2Fe+3CO2 一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
c.毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去运输氧气的能力,造成机体缺氧。冬天用煤火取暖,如排气不良,就会发生煤气中毒,就CO中毒。CO重要来源是汽车尾气和煤,石油等含碳燃料的不完全燃烧。
③用途:用作燃料,冶炼金属。 ④碳酸:弱酸,不稳定,易分解H2CO3==CO2↑+H2O
碳酸盐:
1.正盐与酸式盐的比较
| 正盐 | 酸式盐 | |
| 水溶性 | 除K、Na、铵的碳酸盐易溶于水外,其余都难溶于水 | 都溶于水 |
| 热稳定性 | 较稳定 ①K2CO3、Na2CO3等碱金属的正盐受热难分解 ②CaCO3、(NH4)2CO3 等受热易分解 |
受热易分解 2NaHCO3  Na2CO3+ H2O+CO2↑ Na2CO3+ H2O+CO2↑Ca(HCO3)2  CaCO3+H2O+CO2↑ CaCO3+H2O+CO2↑ |
| 与酸反应 | CO32-+2H+== CO2↑+H2O CaCO3+2H+=Ca2+ +H2O+CO2↑ |
HCO3-+H+==H2O+ CO2↑(相同条件下,NaHCO3与酸反应放出CO2的速率比Na2CO3快) |
| 与碱反应 | Na2CO3+Ca(OH)2 ==CaCO3↓+2NaOH | NaHCO3+NaOH==Na2CO3+H2O Ca(HCO3)2+Ca(OH)2==2CaCO3↓+2H2O |
| 转化关系 |  | |
(1)在水中的溶解性:一般地,相同温度下,难溶性正盐的溶解度小于其酸式盐,可(易)溶性正盐的溶解度大于其酸式盐。如CaCO3,难溶于水,Ca(HCO3)2易溶于水;Na2CO3易溶于水,NaHCO3的溶解度比 Na2CO3的小。
(2)与酸或碱反应:强酸的酸式盐只与碱反应而不与酸反应;弱酸的酸式盐与足量强碱反应生成正盐,与足量强酸反应生成弱酸。
(3)热稳定性:一般地,热稳定性的大小顺序为正盐>酸式盐(盐的阳离子相同,成盐的酸相同)。
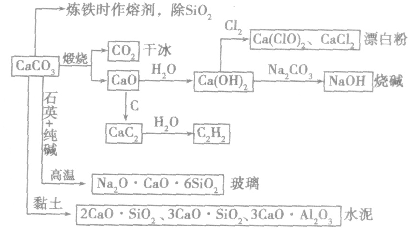
3.碳酸钙在自然界中存在广泛,是岩石的主要成分之一。不溶于水,但溶于酸。大理石、石灰石的主要成分是CaCO3,它们既是重要的化工原料,又是重要的建筑材料。其用途图示如下:
CO2气体与溶液的反应规律:
1.向某溶液中不断通入CO2气体至过量时,现象是“先产生白色沉淀,后沉淀逐渐溶解”
(1)向澄清石灰水中不断通入CO2气体的反应为:
Ca(OH)2+CO2==CaCO3↓+H2O
CaCO3+CO3+H3O==Ca(HCO3)2
(2)向氧氧化钡溶液中不断通入CO2气体的反应为:
Ba(OH)2+CO2==BaCO3↓+H2O
BaCO3+CO2+H2O==Ba(HCO3)2
(3)向漂白粉溶液中不断通入CO2气体的反应为:
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
CaCO3+CO2+H2O==Ca(HCO3)2
2.向某溶液中不断通入CO2气体至过量时,现象为“产生白色沉淀或浑浊,沉淀或浑浊不消失”
(1)在NaAlO2溶液中不断通入CO2气体至过量时,反应为:
2AlO2-+CO2(少量)+3H2O==2Al(OH)3↓ +CO32-
2AlO2-+CO2(过量)+2H2O==Al(OH)3↓ +HCO3-
(2)向Na2SiO3溶液中不断通入CO2气体至过量时,反应为:
SiO32-+CO2+H2O==H2SiO3↓+CO32-
SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-
(3)向饱和Na2CO3溶液中不断通入CO2气体,反应为:
2Na++CO32-+CO2+H2O==2NaHCO3↓
3.CO2与NaOH溶液反应后,溶液中溶质的判断将CO2气体逐渐通入NaOH溶液中,先后发生化学反应:
①CO2+2NaOH==Na2CO3+H2O
②CO2+Na2CO3+H2O==2NaHCO3
向一定量的NaOH溶液中通入CO2气体后,溶液中溶质的成分要根据NaOH与CO2的物质的量之比进行讨论。
当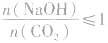 时,发生反应①和②,溶液中的溶质为NaHCO3;
时,发生反应①和②,溶液中的溶质为NaHCO3;
当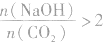 时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
时,发生反应①,溶液中的溶质为 Na2CO3和NaOH;
当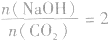 时,发生反应①,溶液中的溶质为Na2CO3;
时,发生反应①,溶液中的溶质为Na2CO3;
当 时,发生反应①和②,溶液中为Na2CO3和NaHCO3
时,发生反应①和②,溶液中为Na2CO3和NaHCO3
碳酸氢盐与碱反应的规律及CO32- HCO3-的鉴别方法:
1.酸式盐与碱反应时的产物要根据相对用量判断
如Ca(HCO3)2溶液中滴加NaOH溶液:
Ca(HCO3)2+NaOH==CaCO3↓+NaHCO3+ H2O(NaOH少量)
Ca(HCO2)2+2NaOH==CaCO3↓+Na2CO3+ 2H2O(NaOH过量)
2.CO32-和HCO3-的鉴别
(1)利用正盐和酸式盐的溶解性可区别CO32-和HCO3-,如分别和BaCl2溶液反应,生成的BaCO3不溶,生成的Ba(HCO3)2易溶;
(2)利用与H+反应产生CO2的快慢检验CO32-或HCO3-
碳族元素:
1.在元素周期表中的位置及结构碳旌死素位于第ⅣA族,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)五种元素。最外层皆有4个电子,这种结构不易得电子也不易失电子,易形成共价键,难形成离子键。
2.主要化合价碳族元素的化合价主要有+2和+4,C、Si、Ge、Sn的+4价化合物较稳定,而Pb的+2价化合物较稳定。
3.氢化物、最高价氧化物及其对应的水化物
氢化物:
最高价氧化物:RO2;
最高价氧化物对应的水化物为H2RO3、 H4RO4或R(OH)4
4.碳族元素的金属性与非金属性的递变规律由C至Pb,核电荷数逐渐增多,原子半径逐渐增大,原子核对最外层电子的吸引能力逐渐减小,失电子能力逐渐增强,得电子能力逐渐减弱,非金属性逐渐减弱,金属性逐渐增强。由碳族元素形成的单质中,碳、硅为非金属,但硅有金属光泽;锗、锡、铅为金属。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: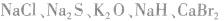 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: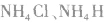 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(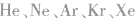 等)。
等)。
炔烃随分子碳原子数的增加,相对分子质量的增加,熔沸点逐渐升高,相对密度逐渐增大;炔烃中n≤4时,常温常压下位气态,其他未液态或固态;炔烃的相对密度一般小于水的密度;炔烃不溶于水,易溶于有机溶剂。可以发生加成反应、加聚反应、氧化反应。
烃类燃烧规律总结:
1.烃完全燃烧时的耗氧量规律
(1)等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+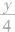 )的值,其值越大,耗氧量越大。
)的值,其值越大,耗氧量越大。
(2)等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
(3)实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
2.质量相同的烃CxHy,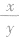 越大,生成的CO2越多; 若两种烃的
越大,生成的CO2越多; 若两种烃的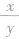 相等,则生成的CO2和H2O的质量均相等。
相等,则生成的CO2和H2O的质量均相等。
3.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
4.不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子、H原子个数比也相同.
5.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮.黑烟越浓,如C2H2(92.3%)、C6H6(92·3%)、C7H8 (91.3%)燃烧时火焰明亮,伴随大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH4(75%)就是如此;对于C2H4及其他单烯烃(均为 85.7%).燃烧时火焰较明亮,并有少量黑烟。
6.气态烃CxHy完全燃烧后生成CO2和H2O 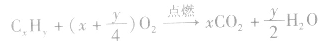
(1)当H2O为气态时(T>100℃),1L气态烃燃烧前后气体总体积的变化有以下三种情况:
当y=4时,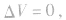 反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
当y>4时,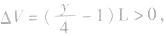 反应后气体总体积增大;
反应后气体总体积增大;
当y<4时,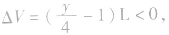 反应后气体总体积减小
反应后气体总体积减小
(2)当H2O为液态时(T<100℃),1L气态烃完全燃烧后气体总体积减小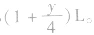
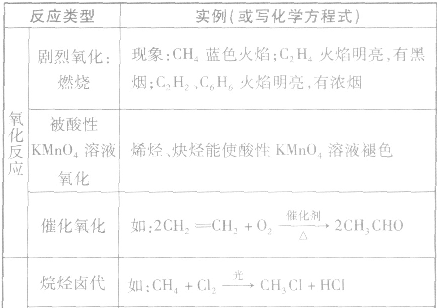
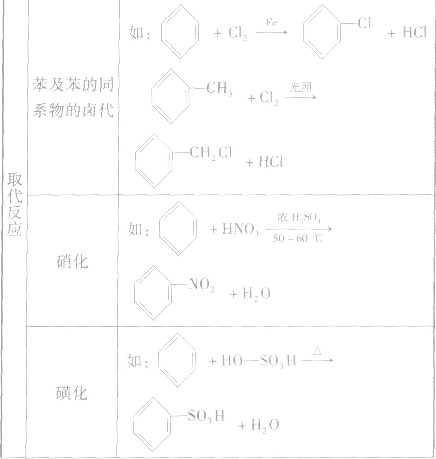
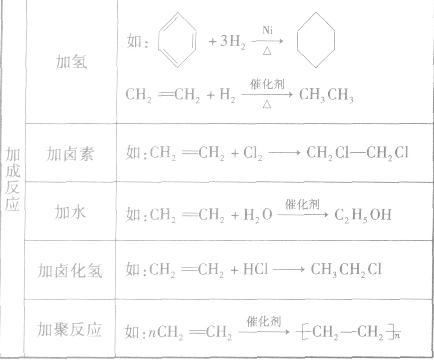
各类烃的反应类型及实例:
同系物:
1.概念结构相似,在分子组成上相差一个或若干个CH2 原子团的有机物,互称为同系物。
2.判断同系物的方法
(1)同系物必符合同一通式。
(2)同系物必为同一类物质。如 和
和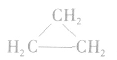 虽都符合通式
虽都符合通式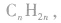 且组成上相差一个CH2原子团,但它们分别属于烯烃和环烷烃,结构不相似,不是同系物。
且组成上相差一个CH2原子团,但它们分别属于烯烃和环烷烃,结构不相似,不是同系物。
(3)同系物化学式不同。
(4)同系物结构相似但不一定完全相同,如 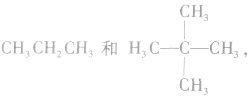 虽前者无支链,而后者有支链,结构不尽相同,但两者碳原子间均以单键结合成链状,结构仍相似,属同系物。
虽前者无支链,而后者有支链,结构不尽相同,但两者碳原子间均以单键结合成链状,结构仍相似,属同系物。
(5)同系物之间的物理性质不同,但化学性质相似。
注意:应用以上方法判断不同物质是否属于同系物时,首先要看两种有机物的结构是否相似、化学性质是否相似,然后再看组成上是否相差一个或若干个CH2原子团,才能快速、准确地作出判断。 与
与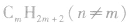 一定是同系物,
一定是同系物,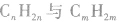 不一定是同系物;
不一定是同系物;
 与
与 与
与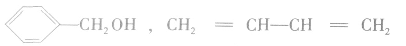 与
与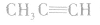 等均不是同系物。
等均不是同系物。
与“1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现...”考查相似的试题有:
- 下列实验过程中,始终无明显现象的是 ( )A.Cl2通入AgNO3溶液中B.CO2通入CaCl2溶液中C.NH3通入AlCl3溶液中D.SO2通入Ba(NO3...
- 下列分子含有的电子数目与HF相同,且只有两个极性共价键的是[ ]A.CO2B.H2OC.NH3D.CH4
- 美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体.美国宇航局(NASA)马里诺娃博士找到了一种比二氧化...
- NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子.根据上述事实,通过比较归纳可推出ABn型分子...
- 提纯下列物质所选试剂及对应分离方法均可行的是 物 质杂 质所 选 试 剂方 法A乙烷乙烯酸性KMnO4溶液洗气B溴苯溴H2O萃取C乙酸...
- 某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子上的氢原子又可被3 mol Cl2取代,则此气态烃可能是[ ]A.B.C.D.
- 下列有关实验的叙述正确的是A.作石油蒸馏实验时,冷凝水应从上口通入,下口流出B.乙醇和乙酸酯化反应后的产物可用饱和的氢...
- 下列数据是一些有机物的相对分子质量,可能为同系物的一组是( )A.16,32,46,60B.16,30,42,56C.16,28,40,52D.16,...
- 下列说法错误的是( )A.同系物一定符合同一通式B.同分异构体一定具有相同的最简式C.一种元素形成不同的物质可能互为同分...
- 下列各组物质的分类,正确的是[ ]A.同位素:红磷、白磷B.非电解质:Cl2、CH3OHC.非极性分子:CO2、CCl4D.同系物: