本试题 “A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层...” 主要考查您对硫化氢
极性分子、非极性分子
元素的推断
极性键、非极性键
电子式的书写
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 硫化氢
- 极性分子、非极性分子
- 元素的推断
- 极性键、非极性键
- 电子式的书写
硫化氢:
H2S的分子结构与H2O相似,呈角形,是一种极性分子,但极性比水弱,不能形成氢键。熔点(-86℃) 和沸点(-71℃)都比水低。
硫化氢的物理性质和化学性质:
1.物理性质:H2S是一种无色,有臭鸡蛋气味的气体,比空气稍重,能溶于水(常温常压下,1体积水中能溶解2.6体积硫化氢)。
2.化学性质:
(1)对热较不稳定

(2)强还原性 
3.氢硫酸氢硫酸是二元弱酸,可分步电离:
具有挥发性,能使石蕊试液变红。氢硫酸具有酸的通性。 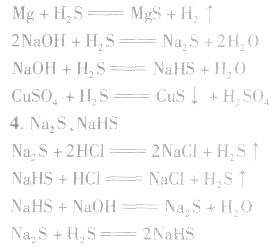
Na2S、NaHS均具有强还原性,在空气中均易被氧化。
S2-遇Fe3+、ClO-、NO3-(H+)等氧化性离子都发生氧化还原反应。
(1)极性分子:正电荷中心和负电荷中心不相重合的分子
(2)非极性分子:正电荷中心和负电荷中心相重合的分子
(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定
非极性分子和极性分子的比较:
| 非极性分子 | 极性分子 | |
| 形成原因 | 整个分子的电荷分布均匀,对称 | 整个分子的电荷分布不均匀、不对称 |
| 存在的共价键 | 非极性键或极性键 | 极性键 |
| 分子内原子排列 | 对称 | 不对称 |

分子极性的判断方法:
An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断
判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的: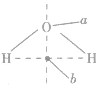 ,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断
将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断
ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、 PCl3等。
4.判断ABn型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、 NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。
元素性质推断知识点归纳:
(1)质量最轻的元素是氢(H),其单质可以填充气球;质量最轻的金属是锂(Li);熔点最高的非金属单质是石墨;熔点最高的金属单质是钨(W);熔点最低的金属单质是汞(Hg)。
(2)地壳中含量最多是氧(O),其次是Si、Al、Fe、Ca、Na、K、Mg、H、Ti。
(3)既难得电子,又难失电子且为单原子分子的气体是稀有气体。
(4)最高正价与最低负价绝对值之差为4的是硫(S);最高正价与最低负价绝对值之差为零的是碳(C)和硅(Si)。
(5)碳(C)是形成化合物最多的元素,是构成有机物的骨架元素,可形成多种同素异形体,其中硬度最大的是金刚石,而C60是分子晶体,熔点较低。
(6)常温下能与水反应放出氧气,单质是氟(F2),化合物是过氧化钠(Na2O2)。
(7)硅(Si)是构成地壳岩石骨架的主要元素,单质硅可被强碱溶液腐蚀且能放出氢气,还能被弱酸氢氟酸所溶解。
(8)能在空气中自然的非金属单质是白磷(P4),白磷有毒,能溶于CS2,和红磷互为同素异形体,红磷不能自然,不溶于CS2,白磷与红磷在一定的条件下可以相互转化。
(9)既能在二氧化碳中燃烧,又能在氮气中燃烧的金属是Mg,既能与酸溶液又能与碱溶液作用且均放出氢气的金属是铝(Al)。
(10)同一元素的气态氢化物和最高价氧化物的水化物化合生成盐的元素一定是氮(N)。
(11)同一元素的气态氢化物和气态氧化物反应生成该元素得单质和水,该元素可能是氮(N)或硫(S)。
(12)光照时可以释放电子的是铷(Rb)和铯(Cs);常温下呈液态的金属是汞(Hg),非金属单质是溴(Br2)。
解元素推断题必备知识归纳
(1)与元素的原子结构相关知识归纳
①最外层电子数等于次外层电子数的元素是Be、Ar;最外层电子数是次外层电子数2倍的元素有C;最外层电子数是次外层电子数3倍的元素有O;最外层电子数是次外层电子数4倍的元素有Ne。
②次外层电子数是最外层电子数2倍的元素有Li、Si;次外层电子数是最外层电子数4倍的元素有Mg。
③内层电子数是最外层电子数2倍的元素有Li、P;电子总数是最外层电子数2倍的元素有Be。原子核内无中子的元素是11H。
④常见等电子微粒:
|
电子数 |
分子 |
阳离子 |
阴离子 |
|
2 |
H2、He |
Li+、Be2+ |
H- |
|
10 |
Ne、HF、H2O、NH3、CH4 |
Na+、Mg2+、Al3+、H3O+、NH4+ | O2-、F-、OH-、NH2- |
|
18 |
Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6、CH3OH |
K+、Ca2+ |
S2-、HS-、Cl- |
①主族序数与周期序数相同的元素有H、Be、Al;主族序数是周期序数2倍的元素有C、S;主族序数是周期序数3倍的元素有O。
②周期序数是主族序数2倍的元素有Li、Ca;周期序数是主族序数3倍的元素有Na。
③最高正价与最低负价的绝对值相等的元素有C、Si;最高正价是最低负价的绝对值3倍的元素有S。
④上一周期元素所形成的阴离子和下一周期元素最高价态阳离子的电子层结构与上一周期零族元素原子的电子层结构相同。
(3)与元素性质相关知识归纳
①元素所形成的单质及化合物的物理特性
A.颜色:常温下,单质为有色气体的元素是F、Cl;单质为淡黄色固体的元素是S;焰色反应火焰呈黄色的元素是Na,呈紫色的元素是K(通过兰色钴玻璃)。
B.状态:常温下,单质呈液态的非金属元素是Br;单质为白色蜡状固体的元素是P。
C.气味:有臭鸡蛋气味的非金属元素是S。
D.熔点:单质熔点最低的金属元素是Hg;熔点最高的金属元素是W。单质熔点最高的非金属元素是C。氢化物熔点最高的非金属元素是O。氧化物熔点最高的非金属元素是Si。
E.硬度:单质为天然物质中硬度最大的元素是C。
F.密度:单质最轻的金属元素是Li;单质最轻的非金属元素是H。
G.溶解性:气态氢化物最易溶于水的元素是N。
H.导电性:单质能导电的非金属元素是C;单质属于半导体材料的是Si。
②元素所形成的单质及化合物的化学特性
A.无正价、无含氧酸的元素是F;单质氧化性最强、其氢化物水溶液可雕刻玻璃的元素是F;气态氢化物稳定性最强的元素是F;最高价氧化物对应的水化物酸性最强的元素是Cl。
B.其两种同素异形体对人类生存都非常重要的元素是O(O3层被称为人类和生物的保护伞);气态氢化物与最低价氧化物能反应生成单质的是S。
C.气态氢化物与最高价氧化物对应水化物能起化合反应的元素是N;气态氢化物能使湿润的红色石蕊试纸变蓝的元素是N;其中一种同素异形体在空气中能自燃的元素是P。
③元素性质递变规律
A.元素金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,金属性逐渐减弱;同一主族中,由上到下,金属性逐渐增强。
II.依据最高价氧化物的水化物碱性强弱,碱性越强,金属性越强。
III.依据金属活动性顺序(极少数例外)。
IV.依据金属单质与酸或水反应的剧烈程度,反应越剧烈,金属性越强。
V.依据金属单质与盐溶液之间的置换反应。
VI.依据原电池原理,原电池中作负极的金属比作正极的金属金属性强。
VII.依据电解原理,电解时,阴极上后析出的金属比先析出的金属金属性强。
B.元素非金属性强弱比较规律
I.依据元素周期表,同一周期中,从左到右,非金属性逐渐增强;同一主族中,由上到下,非金属性逐渐减弱。
II.依据最高价氧化物的水化物的酸性强弱,酸性越强,非金属性越强。
III.依据与H2化合的难易,越容易化合,非金属性越强。
IV.依据其气态氢化物的稳定性,稳定性越强,非金属性越强。
V.依据非金属单质与盐溶液之间的置换反应。
C.微粒半径大小比较规律
I.同周期阳离子半径随原子序数递增逐渐减小,如第3周期中:Na+>Mg2+>Al3+;同周期阴离子半径随原子序数递增逐渐减小,如第3周期中:P3->S2->Cl-。
II.同主族阳离子半径随原子序数递增逐渐增大,如第IA族中:Li<Na+<K+,同主族阴离子半径随原子序数递增逐渐增大,如第VIIA族中:F-<Cl-<Br-。
III.阳离子半径总比相应原子半径小,如Na+<Na,阴离子半径总比相应原子半径大,如S2->S。
IV.电子层结构相同的离子半径随原子序数的增大而减小,如S2->Cl->K+>Ca2+,O2->F->Na+>Mg2+>Al3+。
④元素的含量地壳中质量分数最大的元素是O,其次是Si;地壳中质量分数最大的金属元素是Al,其次是Fe;氢化物中氢元素质量分数最大的是C;所形成的有机化合物中种类最多的是C。
(3)解元素推断题的方法解答元素推断题,必须抓住原子结构和元素的有关性质,掌握元素周期表中主要规律,熟悉某些元素(短周期或前20号元素)的性质、存在和用途的特殊性,用分析推理法确定未知元素在周期表中的位置。对于有突破口的元素推断题,可利用题目暗示的突破口,联系其它条件,顺藤摸瓜,各个击破,推出结论。对无明显突破口的元素推断题,可利用题示条件的限定,逐渐缩小推求范围,并充分考虑各元素的相互关系予以推断。有时限制条件不足,则可进行讨论,得出合理结论,有时答案不止一组,只要能解释通都可以,若题目只要求一组,则选择自己最熟悉、最有把握的。有时需要运用直觉,大胆尝试、假设,再根据题给条件进行验证,也可推出。
(1)非极性键:同种元素的原子间形成的共价键(共用电子对不偏移,成键原子双方不显电性)。
如:在非金属单质(H2 Cl2 O2)、共价化合物(H2O2 多碳化合物)、离子化合物(Na2O2 CaC2)中存在。
(2)极性键:不同元素的原子间形成的共价键(共用电子对偏向吸引电子能了强的一方,该元素显负价,偏离吸引电子能力弱的一方,该元素显正价)。如:在共价化合物(HCl H2O CO2 NH3)、某些离子化合物(NaOH Na2SO4 NH4Cl)中存在。
分子空间构型、键的极性与分子的极性:

化学键与物质类别:
1.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物。例如: 等。
等。
2.只含非极性共价键的物质:同种非金属元素构成的单质。例如: 、金刚石等。
、金刚石等。
3.既有极性键又有非极性键的物质。例如: 等。
等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。例如: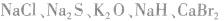 等。
等。
5.既有离子键又有非极性键的物质。例如: 等。
等。
6.既有离子键又有极性键的物质。例如: 等。
等。
7.由离子键、共价键、配位键构成的物质。例如: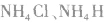 等。
等。
8.只含有共价键而无范德华力的物质。例如:金刚石、晶体硅、 等原子晶体。
等原子晶体。
9.由强极性键构成但又不是强电解质的物质。例如:HF。
10.没有化学键的物质。例如:稀有气体(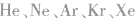 等)。
等)。
定义:
在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“· ”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
(1)原子的电子式:H· 、Na· 、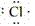
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样:Na+、Al3+、Mg2+
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n-”: 、
、 、
、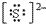
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并: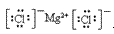 、
、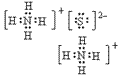
(5)共价化合物的电子式:画出离子最外层电子数: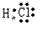 、
、
(6)用电子式表示物质形成的过程:
氯化氢的形成过程: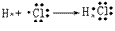
氯化镁的形成过程: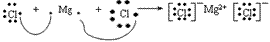
结构式:
共价键中的每一对共用电子用一根短线表示,未成键电子不写出,物质的电子式就变成了结构式。
例如: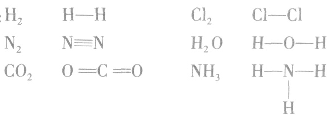
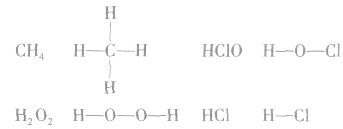
书写电子式的常见错误:
1.漏写未参与成键的电子,如: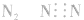
2.化合物类型不清,漏写或多写“[]”及错写电荷数,如: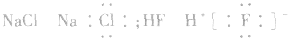
3.书写不规范,错写共用电子对如:N2的电子式为: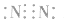 ,不能写成:
,不能写成: ,更不能写成:
,更不能写成: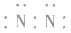 或
或 。
。
4.不考虑原子间的结合顺序如:HClO的电子式为 ,而非
,而非 。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
。因氧原子需形成2对共用电子才能达到稳定结构,而H、 Cl各需形成1对共用电子就能达到稳定结构。
5.不考虑原子最外层有几个电子均写成8电子结构如: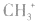 的电子式为
的电子式为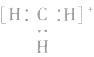 ,而非
,而非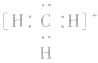 , 因
, 因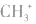 中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
中碳原子最外层应有6个电子(包括共用电子),而非8个电子。
6.不清楚A如型离子化合物中两个B是分开写还是写一块如: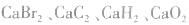 中
中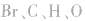 均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为:
均为-l 价,Br-、H-已达到稳定结构,应分开写;C原子得一个电子,最外层有5个电子,需形成三对共用电子才能达到稳定结构,不能分开写;氧原子得一个电子,最外层有7个电子,需形成一对共用电子才能达到稳定结构,也不能分开写。它们的电子式分别为: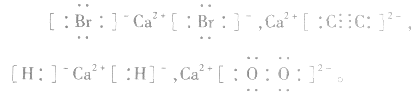
与“A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递...”考查相似的试题有:
- 已知离子键的键能与阴阳离子的电荷乘积成正比,与离子间的距离平方(可视为阴阳离子半径之和)成反比,若阳离子是Na+、K+、Rb...
- 已知某碳纳米管为单、双键交替共轭结构,电子传输效果很好,可用作导电材料。现有1根由180个碳原子构成的碳纳米管,若要将这...
- 分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是[ ]A.只含非极性键的分子一定是非极性分子B....
- 某主族元素R的原子其电子式可用下式表示:。该元素组成的以下物质,其分子式肯定错误的是[ ]A.最高价氧化物分子式为R2O5B....
- 下列电子式或结构式错误的是[ ]A.OH-的电子式B.NH4Br的电子式C.CCl4电子式D.H2O的结构式
- 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴...
- 下列微粒中:①13Al3+②③④F-,其核外电子数相同的是[ ]A.①②③B.②③④ C.①②④D.①③④
- 已知A、B、C、D、E都是短周期主族元素,且原子序数依次增大.A、B原子的质子数之和等于C原子核内的质子数,D与B原子核外电子...
- 下列电子式正确的是( )A.B.C.D.
- 下列分子的电子式,书写正确的是[ ]A.氨B.四氯化碳C.氮D.二氧化碳