本试题 “红磷燃烧除需要氧气外,还需满足的条件是_______;该反应的化学方程式___________ ;用红磷做“测定空气里氧气含量”的实验时,若红磷的量不足,所测得氧气的体...” 主要考查您对空气中氧气含量的测定
化学反应方程式的书写
燃烧与燃烧的条件
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 空气中氧气含量的测定
- 化学反应方程式的书写
- 燃烧与燃烧的条件
空气中氧气含量的测定实验是初中化学的一个重要实验,同时也是历年各地中考命题的热点。近年来在课本实验的基础上进行拓展、创新,旨在考查同学们的实验探究能力及创新思维能力已成为中考命题的趋势。
空气中氧气含量的测定实验:
| 原理 | 利用红磷在空气中燃烧,将瓶内氧气消耗掉,生成五氧化二磷固体,使空气内压强减少,在大气压作用下,进入容器内水的体积即为减少的氧气的体积。4P + 5O2 2P2O5 2P2O5 |
| 装置 | 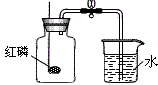 |
| 步骤 | ①连接装置,检查装置气密性 ②把集气瓶的容积分成5等份,做好记号。 ③用止水夹夹紧胶管。 ④在燃烧匙内放入过量的红磷。 ⑤点燃燃烧匙中的红磷,立即伸入集气瓶中,把塞子塞紧 ⑥待红磷熄灭并冷却后,打开止水阀 |
| 现象 | ①集气瓶中有大量的白烟生成,并放出热量 ②打开止水夹,烧杯中的水倒流到集气瓶中,并上升到约1/5处 |
| 结论 | 空气中氧气的体积分数约为1/5。 |
实验中的注意事项:
1.测定空气中氧气的体积分数时,所用物质应满足的条件:
①此物质能够在空气中中燃烧,不能用铁丝代替,铁丝在空气中不能燃烧
②此物质在空气中燃烧的时只能消耗氧气,不能消耗其他气体。不能选用镁代替红磷,因为镁不仅与空气中的氧气反应,还和二氧化碳反应。
③此物质在空气中燃烧时只能生成固体,而不能生成气体,一般不用木炭,硫代替红磷。
2.实验失败与成功的原因:
①装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
②实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
③实验完毕,待容器冷却至室温后,再打开止水夹,观察进水的体积,避免因温度高,气体膨胀,使测定结果低于1/5.
空气中氧气含量测定实验的改进:
1.测定原理:
(1)红磷(白磷)在密闭的容器中燃烧,消耗氧气,生成白色固体五氧化二磷。密闭容器内压强减小,大气压将水压入容器,通过测定容器中的水的量测定氧气在空气中的含量。
(2)利用金属与氧气反应,消耗密闭容器中的氧气使密闭容器内压强减小,在大气压的作用下,推动刻度器上的活塞移动,测出氧气体积。
2.装置
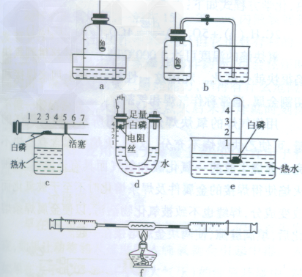
3.实验现象
(1)红磷(白磷)燃烧,产生大量白烟
(2)a中睡眠上升约占钟罩内空气体积的1/5
b中进入集气瓶中水的体积约占集气瓶液面以上容积的1/5
c中活塞移动到4处
d中U形管左侧液面上升至刻度1处
e中试管中液面上升至刻度1处
f中右侧的活塞会左移
4.结论
空气中氧气体积约占空气总体积的1/5
5.注意事项
(1)实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
(2)装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
(3)不能用硫、木炭、铁丝等代替红磷(白磷)。因为硫或木炭燃烧后产生的气体会弥补反应所消耗的氧气,导致测得的体积不准确,而细铁丝在空气中难以燃烧,氧气体积几乎不变,因此密闭空气内水面不上升。
(4)导气管要夹紧,燃烧匙放入集气瓶时要迅速,防止空气受热膨胀,从导气管或集气瓶逸出,导致进入水的体积增多,使实验结果偏高。
化学方程式的书写原则遵循两个原则:
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。
化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3 CaO+ CO2↑
CaO+ CO2↑
(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2 CO2
CO2
(3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2 2CuO
2CuO
④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
一是必须以客观事实为基础,绝不能凭空设想、主观臆造事实上不存在的物质和化学反应;
二是遵循质量守恒定律,即方程式两边各种原子的种类和数目必须相等。
书写化学方程式的具体步骤:
(1)写:根据实验事实写出反应物和生成物的化学式。反应物在左,生成物在右,中间用横线连接,如: H2+O2——H2O,H2O——H2+O2。
(2)配:根据反应前后原子的种类和数目不变的原则,在反应物和生成物的化学式前配上适当的化学计量数,使各种元素的原子个数在反应前后相等,然后将横线变成等号。配平后,化学式前的化学计量数之比应是最简整数比,如:2H2+O2=2H2O,2H2O= 2H2+O2。
(3)注:注明反应条件【如点燃、加热(常用“△”表示)、光照、通电等〕和生成物的状态(气体用“↑”。沉淀用“↓”。)。如:2H2+O2
 2H2O,2H2O
2H2O,2H2O 2H2↑+O2↑。
2H2↑+O2↑。 化学计量数:
化学计量数指配平化学方程式后,化学式前面的数字。在化学方程式中,各化学式前的化学计量数之比应是最简整数比,计数量为1时,一般不写出。
书学化学方程式的常见错误:
| 常见错误 | 违背规律 |
| 写错物质的化学式 | 客观事实 |
| 臆造生成物或事实上不存在的化学反应 | |
| 写错或漏泄反应条件 | |
| 化学方程式没有配平 | 质量守恒 |
| 漏标多标“↑”、“↓”符号 | —— |
书写化学方程式时条件和气体、沉淀符号的使用:
(1).“△”的使用
①“△”是表示加热的符号,它所表示的温度一般泛指用酒精灯加热的温度。
②如果一个反应在酒精灯加热的条件下能发生,书写化学方程式时就用“△”,如:2KMnO4
 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。 ③如果一个反应需要的温度高于用酒精灯加热的温度,一般用“高温”表示;如:CaCO3
 CaO+ CO2↑
CaO+ CO2↑(2)“↑”的使用
①“↑”表示生成物是气态,只能出现在等号的右边。
②当反应物为固体、液体,且生成的气体能从反应体系中逸出来,气体化学式后应该加“↑”。如Fe+ 2HCl==FeCl2+H2↑。
③当反应物是溶液时,生成的气体容易溶于水而不能从反应体系中逸出来,则不用“↑”,如:H2SO4+ BaCl2==FeCl2+2HCl
④只有生成物在该反应的温度下为气态,才能使用“↑”。
⑤若反应物中有气态物质,则生成的气体不用标 “↑”。如:C+O2
 CO2
CO2 (3)“↓”使用
①“↓”表示难溶性固体生成物,只能出现在等号的右边
②当反应在溶液中进行,有沉淀生成时,用 “↓”,如:AgNO3+HCl==AgCl↓+HNO3
③当反应不在溶液中进行,尽管生成物有不溶性固体,也不用标“↓”,如:2Cu+O2
 2CuO
2CuO ④反应在溶液中进行,若反应物中有难溶性物质,生成物中的难溶性物质后面也不用标“↓”。如:Fe +CuSO4==FeSO4+Cu.
化学方程式中“↑”和“↓”的应用:
①“↑”或“↓”是生成物状态符号,无论反应物是气体还是固体,都不能标“↑”或“↓”;
②若反应在溶液中进行且生成物中有沉淀,则使用“↓”;若不在溶液中进行,无论生成物中是否有固体或难溶物,都不使用“↓”;
③常温下,若反应物中无气体,生成物中有气体.
提取信息书写化学方程式的方法:
书写信息型化学方程式是中考热点,题目涉及社会、生产、生活、科技等各个领域,充分体现了化学学科的重要性,并考查了同学们接受信息、分析问题和解决问题的能力。解答这类题日的关键是掌握好化学方程式的书写步骤,可按两步进行:首先正确书写反应物和生成物的化学式,并注明反应条件及生成物状态;第二步就是化学方程式的配平。
概念:
燃烧是指可燃物与氧气发生的一种发光放热的剧烈的氧化反应。
燃烧的三个条件:
物质具有可燃性,可燃物与氧气接触,温度达到可燃物的着火点
促进物质燃烧的方法:
(1)增大氧气的浓度
(2)增大可燃物与氧气的接触面积
对燃烧概念的理解:
通常所说的燃烧是一种可燃物与空气中的氧气发生的一种发光、发热的剧烈的氧化反应。但实际上燃烧并不一定有氧气参加,任何发光、发热的剧烈化学反应都可称之为“燃烧”。
如2Mg+CO2
 2MgO+C;2Na+Cl2
2MgO+C;2Na+Cl2 2NaCl
2NaCl燃烧与发光,放热,火焰之间的关系:
(1)燃烧与发光,放热的关系
燃烧一定发光,放热,但发光,放热的变化不一定是化学变化,因而不一定是燃烧,如原子弹,氢弹的爆炸。
(2)燃烧与火焰的关系
火焰是气体物质燃烧所特有的现象、液体物质的燃烧主要是其蒸气的燃烧,因而产生火馅。若固体物质的沸点较高.燃烧时无蒸气逸出,则无火焰,如铁勺燃烧:若固体物质的沸点较低,燃烧时有蒸气逸出,就有火馅,如钠、硫的燃烧。
(3)发光与放热的关系
化学反应瞬间放出热量较多时.就以光的形式出现,反之则不发光,因此,发光一定收热,放热不一定发光。燃烧反应是既发光又放热的反应,单一的发光或放热反应不一定是燃烧。
影响物质着火点的因素:
着火点不是同定不变的。对同体燃料来说,着火点的高低跟表面积的大小、材料的粗细、导热系数的大小有关系。颗粒越细,表而积越大.导热系数越小,着火点越低,所以块状的木材难点燃,向木材的刨花很好点燃。对于液体燃料和气体燃料来说,火焰接触它们的情况和外界压强的大小有关系,所以测定物质的着火点对外界条件有一定标准。
(1)内在因素
可燃物的性质,不同种物质燃烧的现象不同。例如,硫在空气中燃烧发出淡监色火焰,细铁丝在空气中却不能燃烧。
(2)外部因素
①与氧气的接触面积越大,燃烧越剧烈,如煤的燃烧经历了煤块→煤球→蜂窝煤的过程,蜂窝煤能使煤更充分燃烧的原因是与空气的接触面积增大;如俗语说“人要实,火要虚”。
②氧气的浓度越大,燃烧就越剧烈。如硫在空气燃烧发出淡蓝色火焰,而在氧气中燃烧发出蓝紫色火焰。可燃物在纯氧中比在空气中燃烧会更剧烈。
燃烧的利与弊
燃烧会放出入量,人类需要的大部分能量来源于化石燃料的燃烧.人类利用燃烧放出的热量,可以做饭、取暖、发电、冶烁金属等,但燃蛲也有不利的地方,燃料燃烧不充分时,不仅产生的热量少,浪费资源,而且还会产生CO等物质,污染环境
发现相似题
与“红磷燃烧除需要氧气外,还需满足的条件是_______;该反应的化...”考查相似的试题有:
- 二氧化碳和氧气是自然界中生命活动不可缺少的两种气体,下列对它们的认识中,正确的是A.都含有氧气 B.都能供给动物呼吸C....
- 如图是测定空气中氧气体积分数的实验,实验后发现测定氧气的含量低于15,针对这一事实,你认为下列做法和想法不可取的是( )...
- 用数字和化学符号填空①2个氢原子 ②2个氧分子 ③钙元素 ④+3价的铝元素 ⑤一个镁离子 ⑥2个硫酸根离子 ⑦相对分子量最小的氧化物 ⑧...
- 下列化学方程式书写正确的是( )A.铁在氧气中燃烧4Fe+3O 点燃 . 2Fe2O3B.氧化汞加热分解HgO=Hg+O2↑C.硫在氧气中燃烧S+O ...
- 机动车排放的尾气中,含有碳氢化合物、CO、CO2、氮的氧化物(如NO)等物质,因而是城市空气的污染源之一.(1)尾气中的_____...
- 现有铁、硝酸钡溶液、氢氧化钠溶液、硫酸铜溶液、稀硫酸,在常温下能两两间发生的反应中,属于置换反应的有______个,属于复...
- (4分)请按要求从氮气、铜、氧化钙、氢氧化钙、氢氧化铁、氯化钠、盐酸中选择合适的物质,将其化学式填写在下列横线上:(1...
- 用化学符号表示:锌元素 、氯离子 、硫酸亚铁 、可用于人工降雨的氧化物是 ;可用于实验室制取氢气的酸是 ;加入汽油中可用作...
- 科学研究发现,金星大气层的成分之一是三氧化二碳(C2O3),下列说法正确的A.C2O3的摩尔质量是72gB.1 mol C2O3中含有1molO3...
- 下列化学方程式正确的是[ ]A.Cu+2HCl=CuCl2+H2↑B.BaCl2+2KOH=Ba(OH)2↓+2KCl2C.Fe +2KNO3=2K+Fe(NO3)2D.NaOH+HN...