本试题 “下列说法正确的是[ ]A.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属B.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同C.不含金属元...” 主要考查您对置换反应
氧化钠
过氧化钠
离子化合物
盐类水解判断溶液酸碱性或比较溶液pH值的大小
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 置换反应
- 氧化钠
- 过氧化钠
- 离子化合物
- 盐类水解判断溶液酸碱性或比较溶液pH值的大小
置换反应:
单质与化合物反应生成另外的单质和化合物的化学反应
发生置换反应的原理:
必须是活动性强的金属置换活动性弱的金属或H+溶液
根据元素性质分类:
1.金属单质置换金属单质:2Al+Fe2O3=高温=Al2O3+2Fe(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换);Fe+CuSO4=FeSO4+Cu
2.金属单质置换非金属单质:Zn+2HCl=H2↑+ZnCl2 ;2Na+2H2O=2NaOH+H2↑;2Mg+CO2=点燃=2MgO+C;3Fe+4H2O(g)=高温=Fe3O4+4H2
3.非金属单质置换金属单质:H2+CuO=Δ=Cu+H2O ;C+FeO=Δ=Fe+CO↑
4.非金属单质置换非金属单质:2F2+2H2O=4HF+O2 ;2C+SiO2=Si+2CO↑ ;C+H2O=高温=CO+H2 ;2H2+SiCl4=Si+4HCl ;Cl2+2NaBr=Br2+2NaCl
置换反应与氧化还原反应的关系:
置换反应一定属于氧化还原反应。
氧化钠的基本性质:
白色固体,碱性氧化物,不稳定
(1)与水反应:Na2O+H2O==2NaOH
(2)与CO2反应:Na2O+CO2==Na2CO3
(3)与HCl反应:Na2O+2HCl==2NaCl+H2O
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 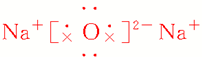 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2 气体体积差 ①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2 气体体积差 ②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算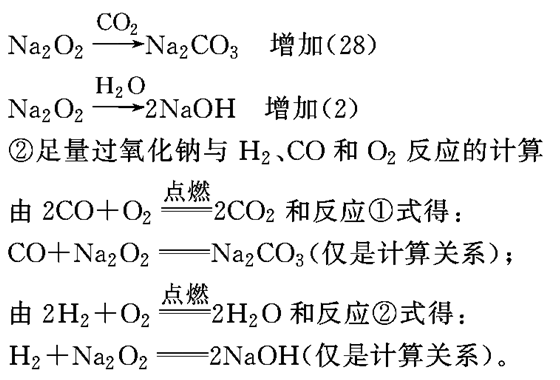
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
氧化钠与过氧化钠的比较:
| 物质 | 氧化钠 | 过氧化钠 |
| 色态 | 白色固体 | 淡黄色固体 |
| 类别 | 碱性氧化物 |
过氧化物(不属于碱性氧化物) |
| 化学键类型 | 仅含离子键 | 离子键和非极性键 |
| 电子式 | 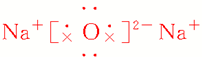 |
 |
| 生成条件 | 常温 | 点燃或加热 |
| 氧的化合价 | -2 | -1 |
| 阴阳离子个数比 | 1:2 | 1:2 |
| 稳定性 | 不稳定 | 稳定 |
| 转化关系 | 2Na2O+O2=2Na2O2 | |
| 用途 | 用于制取少量过氧化钠 | 供氧剂、漂白剂、氧化剂 |
| 与水反应方程式 | 2Na2O+2H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2↑ |
| 与CO2反应 | Na2O+CO2=NaCO3 | 2Na2O2+2CO2=2Na2CO3+O2↑ |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
| 保存 | 隔绝空气、密封保存 | 隔绝空气、远离易燃物、密封保存 |
特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断:
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: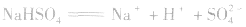
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如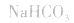 溶液中:
溶液中: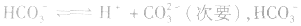
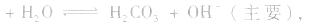
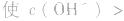
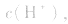 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如 溶液中:
溶液中: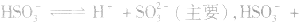
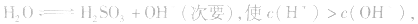 溶液显酸性
溶液显酸性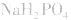 溶液亦显酸性。
溶液亦显酸性。
盐溶液蒸干后所得物质的判断:
1.考虑盐是否分解。如加热蒸干 溶液,因
溶液,因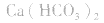 分解,所得固体应是
分解,所得固体应是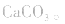
2.考虑氧化还原反应。如加热蒸干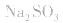 溶液,因
溶液,因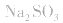 易被氧化,所得固体应是
易被氧化,所得固体应是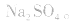
3.盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干 溶液,得
溶液,得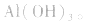 盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干
盐水解生成不挥发性酸时,蒸干后一般仍为原物质,如蒸干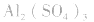 溶液,得
溶液,得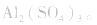
4.盐水解生成强碱时,蒸干后一般得到原物质,如蒸干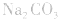 溶液,得到
溶液,得到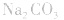 等。
等。
5.有时要多方面考虑,如加热蒸干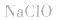 溶液时,既要考虑水解,又要考虑
溶液时,既要考虑水解,又要考虑 的分解,所得固体为
的分解,所得固体为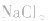
与“下列说法正确的是[ ]A.金属比非金属易失电子,所以金属可以置...”考查相似的试题有:
- (10分)现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 m...
- 在一定条件下可实现下列物质间的转化,如下图所示:(1)固体A是一种重要的工业原料,其化学式为____________________。W的电...
- (4分)方程式书写:(1)镁条在二氧化碳中燃烧的反应: (2)小块钠投入到水中的离子反应:
- 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的...
- 下列对于Na2O、Na2O2的比较正确的一项是[ ]A. Na2O2、Na2O都是钠的氧化物,都是碱性氧化物B. Na2O、Na2O2都是易溶于水(与水...
- 2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞。据...
- 下列说法正确的是( )A.熔化状态下能导电的物质一定是离子化合物B.离子化合物均能溶于水C.离子化合物不可能由非金属元素...
- 叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击时会发生爆炸生成氮气.有关叠氮酸的叙述中正确的是①NaN3的水溶液呈碱性 ②HN3...
- 25℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是[ ]A.BOH溶于水,其电离方程式是BOH=B++OH-...
- (11分)按要求回答下列问题(1)KHSO4溶液显 __性(填“酸” “碱” 或“中性”),其原因是(用电离方程式表示) ;(2) KHCO3溶液显 _...