本试题 “烟气中NOx是NO和NO2的混合物(不含N2O4)。(1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO_________...” 主要考查您对大气污染、改善大气质量
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 大气污染、改善大气质量
- 氧化还原反应的计算
大气污染:
(1)大气污染源:颗粒物、硫的氧化物、氮的氧化物、CO 碳氢化合物、氟氯代烷
(2)大气污染危害:危害人体健康、影响动植物的生长、严重时会影响地球的气候
(3)全球性三大环境问题:酸雨、臭氧层受损、温室效应
①酸雨:正常雨水:PH约为5.6 酸雨:PH小于5.6 我国为硫酸型酸雨,烧煤炭造成
硫酸型:硫的氧化物转化 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 大气中烟尘和O3作催化剂
硝酸型:氮的氧化物转化 3NO2+H2O=2HNO3+NO↑
②臭氧层:自然界的臭氧90%集中在距地面15-50km的大气平流层中 吸收自太阳的大部分紫外线
引起臭氧层受损物质 氟氯代烷(致冷剂)、哈龙(含溴的灭火剂)、CCl4、N2O、NO、核弹爆炸产物
保护臭氧层公约:《保护臭氧层维也纳公约》 《关于消耗臭氧层物质的蒙特利尔议定书公约》
③温室效应:太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长短辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应
温室效应后果:荒漠将扩大,土地侵蚀加重,森林退向极地,旱涝灾害严重,雨量将增加7-11%;温带冬天更湿,夏天更旱;热带也将变得更湿,干热的副热带变得更干旱,两极冰块将熔化,使海平面上升1米多,引起厄尔尼诺现象
引起温室效应的物质:CO2、CH4、N2O、氟氯代烷
改善大气质量:
①减少煤等化石燃料燃烧产生污染:改善燃煤质量、改进燃烧装置、技术和排烟设备、发展洁净煤技术和综合利用、调整和优化能源结构
煤的综合利用: 煤的的干馏、煤的气化、煤的液化
煤的气化 C+H2O(g)=CO+H2
煤的液化 CO+2H2→CH3OH
煤的脱硫 2CaCO3+O2+2SO2=2CaSO4+2CO2
②减少汽车等机动车尾气污染
尾气污染(占大气污染排出总量的40-50%):CO、NO2、NO、碳氢化合物
使用无铅汽油:四乙基铅作抗爆震剂,铅对神经系统损害大
尾气系统加催化转化器:前半部 2CO+2NO2 CO2+N2 后半部 2CO+O2
CO2+N2 后半部 2CO+O2 2CO2 C7H16+11O2
2CO2 C7H16+11O2 7CO2+8H2O
7CO2+8H2O
(1)大气污染源:颗粒物、硫的氧化物、氮的氧化物、CO 碳氢化合物、氟氯代烷
(2)大气污染危害:危害人体健康、影响动植物的生长、严重时会影响地球的气候
(3)全球性三大环境问题:酸雨、臭氧层受损、温室效应
①酸雨:正常雨水:PH约为5.6 酸雨:PH小于5.6 我国为硫酸型酸雨,烧煤炭造成
硫酸型:硫的氧化物转化 SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 大气中烟尘和O3作催化剂
硝酸型:氮的氧化物转化 3NO2+H2O=2HNO3+NO↑
②臭氧层:自然界的臭氧90%集中在距地面15-50km的大气平流层中 吸收自太阳的大部分紫外线
引起臭氧层受损物质 氟氯代烷(致冷剂)、哈龙(含溴的灭火剂)、CCl4、N2O、NO、核弹爆炸产物
保护臭氧层公约:《保护臭氧层维也纳公约》 《关于消耗臭氧层物质的蒙特利尔议定书公约》
③温室效应:太阳短波辐射可以透过大气射入地面,而地面增暖后放出的长短辐射却被大气中的二氧化碳等物质所吸收,从而产生大气变暖的效应
温室效应后果:荒漠将扩大,土地侵蚀加重,森林退向极地,旱涝灾害严重,雨量将增加7-11%;温带冬天更湿,夏天更旱;热带也将变得更湿,干热的副热带变得更干旱,两极冰块将熔化,使海平面上升1米多,引起厄尔尼诺现象
引起温室效应的物质:CO2、CH4、N2O、氟氯代烷
改善大气质量:
①减少煤等化石燃料燃烧产生污染:改善燃煤质量、改进燃烧装置、技术和排烟设备、发展洁净煤技术和综合利用、调整和优化能源结构
煤的综合利用: 煤的的干馏、煤的气化、煤的液化
煤的气化 C+H2O(g)=CO+H2
煤的液化 CO+2H2→CH3OH
煤的脱硫 2CaCO3+O2+2SO2=2CaSO4+2CO2
②减少汽车等机动车尾气污染
尾气污染(占大气污染排出总量的40-50%):CO、NO2、NO、碳氢化合物
使用无铅汽油:四乙基铅作抗爆震剂,铅对神经系统损害大
尾气系统加催化转化器:前半部 2CO+2NO2
 CO2+N2 后半部 2CO+O2
CO2+N2 后半部 2CO+O2 2CO2 C7H16+11O2
2CO2 C7H16+11O2 7CO2+8H2O
7CO2+8H2O氧化还原反应的计算:
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
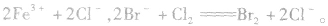 。
。
发现相似题
与“烟气中NOx是NO和NO2的混合物(不含N2O4)。(1)根据废气排放...”考查相似的试题有:
- 产生温室效应的原因主要是大气中含有( )A、SO2B、NO2C、CO2D、CO
- 人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )A.KB.CaC.AlD.Fe
- 有以下报道:①由于石油资源逐渐枯竭,各地都在发展使用乙醇汽油.②“十七大”报告中将节能减排作为环境建设的目标.③为了贯彻“...
- 曾经风靡校园的涂改液中,含有挥发性的有毒溶剂,我们尽量不要使用,以减少对身体的毒害和环境的污染,该溶剂是A.乙醇B.乙...
- “善待地球——科学发展。”下列行为中不符合这一主题的是A.发展循环经济,构建资源节约型社会B.加高工厂的烟囱,使烟尘和废气...
- 化学 与环境保护密切相关,下列叙述正确的是[ ]A.绿色化学的核心是应用化学原理对环境污染进行治理B.处理废水时加入明矾作...
- 实验室常用下列反应制取氯气MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(1) 该反应中HCl作 _________剂,Cl2为_________产物,4 mol HCl...
- a mol FeS 与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H...
- 下列叙述正确的有( )A.等物质的量IO3-、MnO4-中加入足量KI,二者产生I2一样多(已知:MnO4-→Mn2+)B.常温下,c(OH-)=10...
- (NH4)2SO4在加热条件下分解,生成NH3、SO2、N2和H2O.反应中生成的氧化产物和还原产物的物质的量之比为( )A.1:3B.2:3...