本试题 “铁和铁的化合物用途广泛.请回答下列问题:(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:______.将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液...” 主要考查您对原电池原理的应用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理的应用
(1)根据形成原电池判断金属的活动性根据活泼金属为负极,不活泼金属为正极,可通过组成原电池判断金属活动性。
(2)形成原电池可以加快反应速率纯锌与稀H2SO4反应速率较慢,当加入CuSO4溶液以后,反应速率加快,因为Zn+Cu2+=Cu+Zn2+析出的Cu与Zn接触,在稀H2SO4中形成原电池,加快反应速率。
(3)根据原电池原理可以判断电池的正负极、电解质溶液、判断溶液pH的变化
(4)根据原电池原理可以保护金属不被腐蚀
(5)判断金属腐蚀程度的快慢
原电池原理的应用:
1.比较不同金属的活动性强弱
根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或能导电的非金属)作正极。
若有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A极溶解,而B 极上有气体放出,说明在原电池工作过程中,A被氧化成阳离子而失去电子作负极,B作正极,则金属A的金属活动性比B强。
2.加快氧化还原反应的速率
因为形成原电池后,产生电位差,使电子的运动速率加快,从而使反应速率增大,如Zn与稀H2SO4反应制氧气时,可向溶液中滴加少量CuSO4溶液,形成Cu—Zn原电池,加快反应速率 3.用于金属的防护要保护一个铁制闸门,可用导线将其与一锌块相连,使锌作原电池的负极,铁制闸门作正极。
4.设计制作化学电源设计原电池时要紧扣构成原电池的条件。
(1)首先要将已知氧化还原反应拆分为两个半反应:
(2)然后根据原电池的电极反应特点,结合两个半反应找出正、负极材料(一般负极就是失电子的物质,正极用比负极活泼性差的金属或导电的非金属)及电解质溶液:
①电解质溶液的选择电解质溶液一般要能够与负极发生反应,或者能与电极产物发生反应。但如果两个半反应分别在两个容器中进行(中间连接盐桥),左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在铜一锌一硫酸铜构成的原电池中,负极金属锌浸泡在含有 Zn2+“的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中.
②电极材料的选择在原电池中,选择较活泼的金属或还原性较强的物质作为负极,较不活泼的金属或能导电的非金属或氧化性较强的物质作为正极。一般,原电池的负极能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。
(3)举例根据以下反应设计原电池: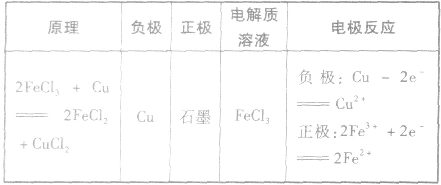
与“铁和铁的化合物用途广泛.请回答下列问题:(1)写出在潮湿空...”考查相似的试题有:
- 铜锌原电池(如图)工作时,下列叙述不正确的是A.锌电极上的反应是:Zn-2e-Zn2+B.铜电极上得到电子,发生还原反应[C.在...
- Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是A.Mg电极...
- (Ⅰ)下列装置能组成原电池的是_____________ (填序号)(Ⅱ)如上图④所示,若是原电池,请回答下列问题(若不是原电池,则不...
- 燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置。下列关于甲烷燃料电池(NaOH溶液作电解质)...
- 锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是A.该电池放电时,正极的反应式为O2+4e-+...
- 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应...
- 有一种原电池,它的一个电极材料是NiO2(在碱中NiO2氧化性比O2更强),还原产物是+2价镍的化合物,另一个电极是铁,电解质溶...
- 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该...
- 据报道,氢燃料电池公交汽车已经驶上北京街头.下列说法正确的是( )A.电解水制取氢气是理想而经济的制氢方法B.发展氢燃料...
- 把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时...