本试题 “根据侯德榜制减法原理并参考下表的数据,实验室制备纯碱Na2CO2的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细...” 主要考查您对工业生产纯碱
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 工业生产纯碱
工业生产纯碱:
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4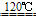 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑
将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3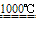 Na2CO3+CaS
Na2CO3+CaS
存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3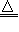 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
氨碱法生产原理:
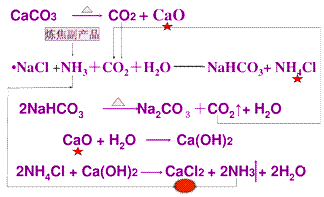
氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
纯碱(学名碳酸钠)实际上是盐,由于它在水中发生水解作用而使溶液呈碱性。纯碱易溶于水,呈强碱性,能提供
Na+离子。这些性质使它们被广泛地用于制玻璃、肥皂、纺织、印染、漂白、造纸、精制石油、冶金及其他化学工业等各部门中。
碳酸钠在自然界中存在相当广泛。一些生长在盐碱地和海岸附近的植物中含有碳酸钠,可以从植物的灰烬中提取;当冬季来临时,碱湖中所含的碳酸钠结晶析出,经过简单的加工就可以使用。
世界上最早是通过路布兰法实现了碳酸钠的工业生产。其生产原理是:
用硫酸将食盐转变成硫酸钠
NaCl+H2SO4
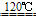 NaHSO4+HCl↑NaCl+NaHSO4
NaHSO4+HCl↑NaCl+NaHSO4 Na2SO4+HCl↑
Na2SO4+HCl↑ 将硫酸钠与木炭、石灰石一起加热,反应生成碳酸钠和硫化钙
Na2SO4+2C
 Na2S+2CO2↑ Na2S+CaCO3
Na2S+2CO2↑ Na2S+CaCO3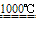 Na2CO3+CaS
Na2CO3+CaS 存在原料利用不充分、成本较高、设备腐蚀严重等
氨碱法生产硫酸:
氨碱法是由比利时人索尔维发明的,所以,氨碱法也称为索尔维制碱法。氨碱法的原料也是氯化钠和碳酸钙,不同的是它还使用了炼焦的副产品氨。
原料:CaCO3、NaCl、NH3
1.生成碳酸氢钠和氯气铵
将CO2通入含NH3的饱和NaCl溶液中
NH3+CO2+H2O==NH4HCO3 NaCl+NH4HCO3==NaHCO3↓+NH4Cl
2.抽取碳酸钠2NaHCO3
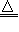 Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 氨碱法生产原理:

氨碱法的优点:原料便宜易得,氨和部分二氧化碳可循环利用,产品纯度高,步骤简单。氨碱法的缺点:副产物氯化钙的处理问题,氯化钠的利用率低。
联合制碱法:
我国化学侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称联合制碱法或侯德榜制碱法,副产品的一种用途为化肥或电解液或焊药等。
(2)沉淀池中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓或NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
(3)写出上述流程中X物质的分子式CO2。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了I 的循环。从沉淀池中取出沉淀的操作是过滤
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加稀硝酸和硝酸银溶液
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:
①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺;这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
发现相似题
与“根据侯德榜制减法原理并参考下表的数据,实验室制备纯碱Na2CO...”考查相似的试题有:
- 纯碱(Na2CO3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na2CO3的流程图.已知:向饱和食盐水中通入NH3、CO2...
- Ⅰ.下列叙述正确的是______.A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)催化剂△2SO3(g)△H<0B.海...
- “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正...
- 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下(1) 上述生产纯碱的方法称___________,副产品的一种用途为...
- (1)实验室中可用如图甲或乙装置与相应的药品制得NH3。①乙中分液漏斗内盛放的物质是____________,圆底烧瓶内的物质是________...
- 过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:2Na2CO3+ 3H2O2=...
- 下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:(1)设备A的名称是________,设备B的名称是___________。(2)有关合成氨...
- 下列有关工业生产的叙述正确的是( )A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率B.联合制碱法是...
- 工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.请回答下列问题:(1)实验室...
- 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原...