本试题 “(I)下列实验操作正确的是______A.将无水乙醇加热至170℃时,可以制得乙烯B.向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素C.用稀HNO3清洗做过银...” 主要考查您对乙醇
物质的分离
物质的鉴别
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醇
- 物质的分离
- 物质的鉴别
乙醇分子的组成与结构:
乙醇分子可以看成是乙烷分子中的一个氢原子被羟基(一OH)取代而形成的。乙醇分子的组成与结构见下表: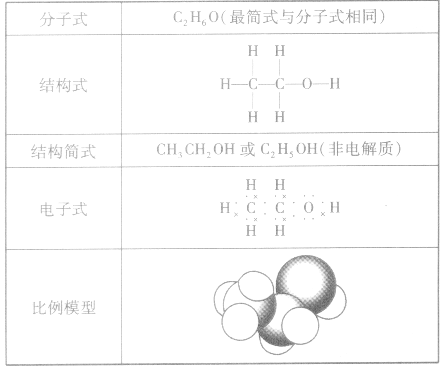
乙醇的性质:
(1)物理性质:俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。
(2)乙醇的化学性质:
①乙醇可以与金属钠反应,产生氢气,但不如水与金属钠反应剧烈。
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
活泼金属(钾、钙、钠、镁、铝)可以将乙醇羟基里的氢取代出来。
②乙醇的氧化反应:
2CH3CH2OH+O2→2CH3CHO+2H2O(条件是在催化剂Cu或Ag的作用下加热)
③乙醇燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2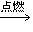 2CO2+3H2O
2CO2+3H2O
④乙醇可以和卤化氢发生取代反应,生成卤代烃和水。
C2H5OH+HBr→C2H5Br+H2O
注意:通常用溴化钠和硫酸的混合物与乙醇加热进行该反应。故常有红棕色气体产生。
⑤乙醇可以在浓硫酸和高温的催化发生脱水反应,随着温度的不同生成物也不同。
A. 消去(分子内脱水)制乙烯(170℃浓硫酸) C2H5OH→CH2=CH2↑+H2O (消去反应)
B. 缩合(分子间脱水)制乙醚(140℃ 浓硫酸) 2C2H5OH→C2H5OC2H5+H2O(取代反应)
有关醇类的反应规律:
1.消去反应的规律
总是消去和羟基所在碳原子相邻的碳原子上的氢原子,没有相邻的碳原子(如CH3OH)或相邻的碳原子上没有氢原子(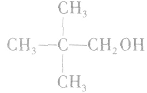 )就不能发生消去反应。能发生消去反应的醇的结构特点为:
)就不能发生消去反应。能发生消去反应的醇的结构特点为: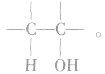
2.催化氧化反应的规律:
与羟基相连的碳原子上若有2个或3个氢原子,羟基则易被氧化为醛;若有1个氢原子,羟基则易被氧化为酮;若没有氢原子,则羟基一般不能被氧化。即
3.酯化反应的规律
醇与羧酸或无机含氧酸发生酯化反应,一般规律是“酸去羟基醇去氢”即酸脱去一OH,醇脱去一H。
例如: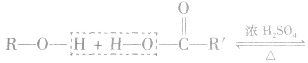

可用氧的同位素: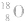 作为示踪原子来确定反应机理。如:
作为示踪原子来确定反应机理。如: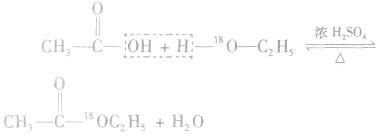
乙醇的工业制法:
(1)乙烯水化法:
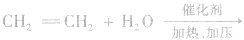
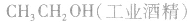
(2)发酵法:

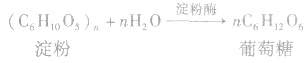
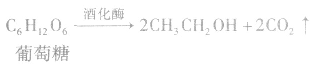
分离与提纯的原则和要求:
(1)选择分离与提纯方法应遵循的原则
①不增:指不能引入新的杂质。
②不减:指应尽可能减少被分离与提纯的物质的损失。
③易分离:指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:指分离物或被提纯的物质都要容易复原。
(2)分离与提纯操作过程应遵循“三必须”
①除杂质试剂必须过量;
②过量试剂必须除尽(因过量试剂会带人新的杂质);
③除杂途径必须选最佳。
常见的分离与提纯的方法:
(1)物质分离与提纯常用的物理方法
| 方法 | 适用范围或原理 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 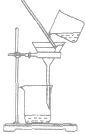 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
| 结晶 重结晶 |
分离各组分在溶剂中的溶解度随温度变化不同的混合物 | 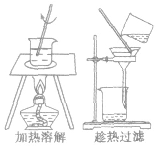 |
KNO3溶解度随温度变化大, NaCl溶解度随温度变化小,可用该法从二者的混合液中提纯KNO3 | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
| 蒸发 | 溶解度随温度变化较小的物质 |  |
从食盐水溶液中提取食盐晶体 | ①溶质应不易分解、不易水解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸干 |
| 蒸馏 | 分离沸点不同的液体混合物 | 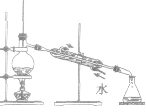 |
制无水乙醇(加生石灰)、硝酸的浓缩[加浓硫酸或 Mg(NO3)2] | ①温度计水银球在蒸馏烧瓶支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下进上出 ④不可蒸干 |
| 分馏 | 分离多种液态混合物 | 同蒸馏 | 石油分馏 | 同蒸馏 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 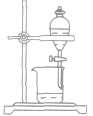 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
| 液化 | 利用气体混合物中某组分易液化的特点来分离 | 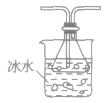 |
除去SO2中的SO3 | 可把锥形瓶换成硬质大试管 |
| 盐析 | 利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质 | —— | 从皂化液中分离肥皂、甘油,蛋白质的盐析 | 盐析是物理变化。盐析之后一般要采取过滤的操作 |
| 洗气 | 杂质气体易溶于某液体 | 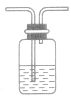 |
除去CO2中的HCl气体,可使混合气体通过盛有饱和NaHCO3 溶液的洗气瓶 | ①从洗气瓶的长导管一端进气 ②混合物中气体溶解度差别较大 |
| 升华 | 利用某些物质有升华的特性 |  |
粗碘中碘与钾、钠、钙、镁的碘化物混合,利用碘易升华的特点将碘与杂质分开 | 升华物质的集取方法不作要求 |
| 渗析 | 胶体提纯、精制 | 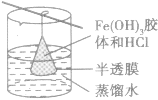 |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
(2)物质分离与提纯常用的化学方法:
①加热法
混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。
②沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。
③转化法
利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。
④酸碱法
被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。
⑤氧化还原法
a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。
b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。
⑥调节pH法
通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。
⑦电解法
此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
根据几种不同物质的性质不同及实验现象不同,将其一一区别开。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。如鉴别一组化合物,就是分别确定各是哪种化合物即可。在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:
(1)化学反应中有颜色变化
(2)化学反应过程中伴随着明显的温度变化(放热或吸热)
(3)反应产物有气体产生
(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
互滴现象不同的化学反应:
1.Na2CO3与稀盐酸的反应
(1)向稀盐酸中滴加Na2CO3溶液,立即有气泡产生。
(2)向Na2CO3溶液中滴加稀盐酸,边滴加边振荡,开始不产生气泡,后来产生气泡。
2.Ca(OH)2溶液与H3PO4溶液的反应
(1)向H3PO4溶液中滴加Ca(OH)2溶液,开始不产生白色沉淀,后来产生白色沉淀。
(2)向Ca(OH)2溶液中滴加H3PO4溶液,肝始有白色沉淀,后来白色沉淀逐渐消失。
3.NaOH溶液与AlCl3溶液的反应
(1)向AlCl3溶液中滴加NaOH溶液,开始产生白色沉淀,后来白色沉淀逐渐消失j
(2)向NaOH溶液中滴加AlCl3溶液,开始不产生白色沉淀,后来产生白色沉淀。
4.NaAlO2溶液与稀盐酸反应
(1)向NaAlO2溶液中滴加稀盐酸,开始有白色沉淀产生,后来白色沉淀逐渐消失。
(2)向稀盐酸中滴加NaAlO2溶液,开始不产生白色沉淀,后来产生白色沉淀。
5.AgNO3溶液与NH3·H2O反应
(1)向NH3·H2O中滴加AgNO3溶液,开始不产生沉淀 
(2)向AgNO3溶液中滴加NH3·H2O,开始出现沉淀,最终沉淀消失。
有机化合物的鉴别方法:
(1)烯烃、二烯、炔烃:
①溴的四氯化碳溶液,红色腿去
②高锰酸钾溶液,紫色腿去。
(2)含有炔氢的炔烃:
①硝酸银,生成炔化银白色沉淀
②氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
(3)小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色
(4)卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
(5)醇:
①与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
②用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
(6)酚或烯醇类化合物:
①用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
②苯酚与溴水生成三溴苯酚白色沉淀。
(7)羰基化合物:
①鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;
②区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
③区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
④鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
(8)甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
(9)胺:区别伯、仲、叔胺有两种方法
①用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
②用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
(10)糖:
①单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
②葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
③麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
(11)使溴水褪色的有机物有:
①不饱和烃(烯、炔、二烯、苯乙烯等);
②不饱和烃的衍生物(烯醇、烯醛等);
③石油产品(裂化气、裂解气、裂化石油等);
④天然橡胶;
⑤苯酚(生成白色沉淀)。
(12)因萃取使溴水褪色的物质有:
①密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);
②密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
(13)使酸性高锰酸钾溶液褪色的有机物有:
①不饱和烃;②苯的同系物;③不饱和烃的衍生物;④部分醇类有机物;⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;⑥石油产品(裂解气、裂化气、裂化石油);⑦天然橡胶。
与“(I)下列实验操作正确的是______A.将无水乙醇加热至170℃时...”考查相似的试题有:
- 现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是物质熔点沸点密度溶解...
- 关于下列各实验装置的叙述中,不正确的是( )A.装置①中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸B.装置②可用于收集H2、N...
- 下列提纯物质方法正确的是A.用BaCl2溶液除去HNO3溶液中的少量H2SO4B.用NaOH溶液除去铝粉中的少量铁粉C.用氯水除去FeCl2溶...
- 下列叙述正确的是( )A.丁达尔效应是区分溶液和胶体的一种常用物理方法B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才...
- 除去下列物质中的少量杂质(括号内的物质为杂质),加入试剂或方法不正确的是A.NaCl溶液(BaCl2):加入足量Na2CO3溶液,过...
- 白酒,食醋,蔗糖,淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是A.鉴别食盐和小苏打B.检验自来水中是否含...
- 在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后( )A.溶液为紫色B.汽油层呈橙色C.汽油层呈紫红色D...
- 复印机使用的墨粉主要成份是Fe3O4,如图是氧化沉淀法生产Fe3O4的工艺:已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参...
- 现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )A.HClB.H2SO4C.Na2SO4D.CaCl2
- 一种试剂能把乙醇、乙酸、甲酸、葡萄糖溶液区别开,这种试剂是( )A.新制Cu(OH)2B.溴水C.银氨溶液D.KMnO4酸性溶液