本试题 “某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。实验一:配制并标定醋酸溶液的浓度取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶...” 主要考查您对弱电解质电离的影响因素
弱电解质的电离度
弱电解质的电离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 弱电解质电离的影响因素
- 弱电解质的电离度
- 弱电解质的电离
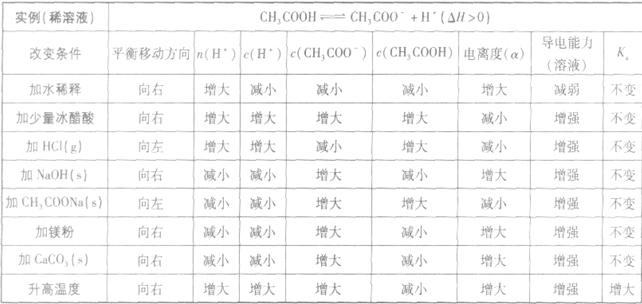
电离平衡的影响因素:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:

电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:
(2)动: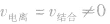 的动态平衡
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。

电离平衡的特征:
(1)等:

(2)动:
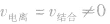 的动态平衡
的动态平衡(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。
发现相似题
与“某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。...”考查相似的试题有:
- 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性变化不大但...
- 常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是A.水电离的...
- 下列事实中能说明亚硝酸是弱电解质的是A.用HNO2溶液作导电试验,灯光较暗B.HNO2是共价化合物C.亚硝酸不与氯化钠反应D.常...
- (3分)请自行设计实验,用至少两种方法证明盐酸的酸性比醋酸的酸性强?可供选者选择的试剂:0.1mol/L的HCl 0.1mol/L的CH3COO...
- 现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是A.电解,NaOH溶液B.蒸馏,Na2CO3溶液C....
- 已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2HCN+Na...
- 下列电离方程式的书写中,正确的是A.NaHS 溶于水::NaHS ==Na++ HS-HS-H++ S2-B.(NH4)2SO4溶于水: (NH4)2SO42NH4++ SO42-C...
- 下列溶液中加入少量NaOH固体导电能力变化不大的是A.盐酸B.CH3COOHC.NH3·H2OD.H2O
- (8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。(1)钠碱循环法...
- 按要求回答下列问题:(1 )用标准NaOH 溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是 ( 填序...