本试题 “某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:(1)操作①②③都要用到得一种玻璃仪器是______;(2)操作②中需要将圆形滤纸折叠处理,下列图示中不...” 主要考查您对溶液的配制
物质的除杂
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶液的配制
- 物质的除杂
知识梳理:
1 、固体 + 水
①实验步骤:计算—称量—量取—溶解
②实验器材:托盘天平 + 药匙(或镊子) ;合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、称量和量取都要准确,溶解时固体要溶解完全
2 、液体 + 水
①实验步骤:计算—量取—溶解
②实验器材:合适的量筒 + 胶头滴管;烧杯 + 玻璃棒
③注意事项:计算、量取都要准确,同时需要两种不同规格的量筒
配制溶液的步骤:
(1)用溶质和水配制一定溶质质量分数的溶液
①实验用品:托盘天平、烧杯、量筒、胶头滴管、玻璃棒、药匙等。
②实验步骤:
计算→称量药品→量取水→搅拌溶解
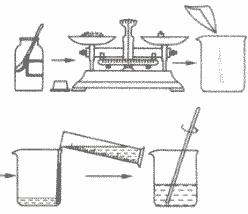
a.计算所需溶质和水的质量;
b.用托盘天平称量所需溶质,倒入烧杯中;
c.把水的密度近似看作1g/cm3,用量筒量取一定体积的水,倒入盛有溶质的烧杯里,用玻璃棒搅拌,使溶质溶解;
d.把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中。
③导致溶液质量分数变化的因素
a.称量时物质和砝码的位置放错,如止确称量5.8gNaCl,应在右盘放置5g砝码,再用0.8g游码,若放错位置,将砝码放在天平的左盘,则实际称量NaCl的质量为5g-0.8g=4.2g,这样会导致配制的溶液溶质质量分数变小;
b.量筒量取水的体积时读取示数错误,读取示数时仰视读数所量取水的实际体积大于理论值,将会使配制的溶液溶质质量分数变小;读取示数时俯视读数所量取水的实际体积小于理论值,将会使配制的溶液溶质质量分数变大;
c.将量筒中的水倒入烧杯时洒落到外面或未倒净,将导致溶液溶质质最分数偏大;
d.所用固体不纯,将会导致溶液溶质质量分数偏小;
e.计算错误可能会导致溶液溶质质量分数偏大或偏小。
配制溶液时导致溶质质量分数变化的原因:
在配制一定质量和一定质量分数的溶液过程中,经常会出现所得溶液溶质质量分数偏大或偏小的情况。
1. 所配溶液溶质质量分数偏小的原因:
①从计算错误角度考虑:水的质量算多了,溶质的质量算少了;
②从用托盘大平称量的角度考虑:天平读数有问题。药品和砝码放颠倒了,左盘放纸片但右盘没有放纸片,调零时,游码未拨回“0”刻度等;
③从用量筒量取液体的角度考虑:量取溶剂时,仰视读数了;
④从转移药品角度考虑:烧杯不干燥或烧杯内有水,量筒中的液体溶质未全部倒人烧杯中;
⑤从药品的纯度角度考虑:溶质中含有杂质
2. 所配溶液溶质质量分数偏大的原因
①称量时,所用砝码已生锈或沾有油污;②量取溶剂时,俯视读数了。
综合配制溶液的计算利用:
所提供的信息可选取多种方案配制所需的溶液。如现有KCl固体、蒸馏水、5%的KCl溶液、15%的KCl溶液,配制100g10%的KCl溶液,其方案有:
| 所需药品 | 主要步骤 | |
| 一 | 10gKCl+90g蒸馏水 | 用天平称量10gKCl,用量筒量取90ml水,分别倒入烧杯,用玻璃棒搅拌至KCl固体全部消失 |
| 二 | 66.7g15%的KCl溶液33.3g蒸馏水 | 用量筒量取33.3mL水,用天平称66.7g15%的KCl溶液,混合均匀即可 |
| 三 | 5.3gKCl+94.7g 5%的KCl溶液 | 用天平称量5.3gKCl固体和94.7g 5%的KCl溶液,将5.3gKCl倒入94.7g5%的KCl溶液中,用玻璃棒搅拌至KCl固体全部消失 |
| 四 | 50g5%KCl溶液+50g15%KCl 溶液 | 用天平称量5%、15%的KCl溶液各50g,混合均匀即可 |
混合物的分离和提纯(除杂)
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。二者的方法在很多情况下是相似的,但分离比提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化而分离后还要复原为原来的组分物质提纯和除杂过程中经常用到分离操作,二者有时又密不可分。
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl3,溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl3中的少量Fe2(SO4)3应选用BaCl2而不应选用Ba(NO3)2,否则发生反应3Ba(NO3)2+Fe2(SO4)3==3BaSO4↓+2Fe(NO3)3溶液中又增加了Fe(NO3)3.
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
常见除杂的方法:
CO2(O2):将气体通过灼热的铜网
CO2(H2或CO):将气体通过灼热的氧化铜
O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂
O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中
Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤
Fe(含Cu):用磁铁将铁粉吸引出来
Cu(含CuO),Fe(含Fe2O3):高温下与H2或CO反应
CuO(含Cu或C):在空气中灼烧
CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2)
CaCO3(含CaO):加足量水溶解,过滤,取滤渣
Ca(OH)2(含CaO)加足量水
FeSO4溶液(含H2SO4或CuSO4),FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液
NaCl溶液(含Na2CO3):加适量稀盐酸
Na2SO4溶液(含CuSO4):加适量 NaOH 溶液
酸、碱、盐溶液的除杂技巧:
1.被提纯物与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去Na2SO4溶液中的NaOH:可选用稀H2SO4溶液为除杂试剂(2NaOH+ H2SO4==Na2SO4+2H2O)、除去KCl溶液中的 K2SO4:可选用BaCl2溶液为除杂试制(K2SO4+BaCl2 ==2KCl+BaSO4↓,过滤除去)
2.被提纯物与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂,如除去NaCl溶液中的BaCl2:可选用 Na2SO4溶液为除杂试剂(BaCl2+Na2SO4=BaSO4↓ +2NaCl,过滤除去).再如除去KNO3溶液中的AgNO3:可选用KCl溶液为除杂试剂(AgNO3+KCl=AgCl↓ +KNO3,过滤除去)。
3.被提纯物质与杂质所含阴离子、阳离子都不相同时,应选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如:除去NaCl溶液中的CuSO4:可选用Ba(OH)2溶液为除杂试剂[CuSO4+Ba(OH)2= BaSO4↓+Cu(OH)2↓,过滤除去]。
分离和提纯的方法:
物质的分离和提纯有两种主要的方法,即物理方法和化学方法。实际上在实验过程中往往需通过综合法来进行。
(1)物理方法主要包括过滤,蒸馏,结晶
(2)化学方法
(3)综合法
在进行混合物的分离或提纯时,采用一种方法往往不能达到目的,而要采用几种方法才能完成,这就是综合法。综合法主要有三种:
①物理方法的综合:主要是溶解、过滤、蒸发、结晶等方法的结合:
②化学方法的综合:当某物质所含杂质不止一种时,通常需加入多种试剂除去(或分离)不同的物质。
③物理与化学方法的综合:当某物质所含杂质不止一种,且有能用物理方法除去(或分离)的杂质时,首先应考虑用物理方法除去一种或几种杂质,然后再用化学方法除去其余杂质。
(4)除杂方法的几个优化原则
①若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
②应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
③先考虑物理方法,再用化学方法。
常见的混合物类型及分类与提纯的方法见下表:
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。二者的方法在很多情况下是相似的,但分离比提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化而分离后还要复原为原来的组分物质提纯和除杂过程中经常用到分离操作,二者有时又密不可分。
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl3,溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl3中的少量Fe2(SO4)3应选用BaCl2而不应选用Ba(NO3)2,否则发生反应3Ba(NO3)2+Fe2(SO4)3==3BaSO4↓+2Fe(NO3)3溶液中又增加了Fe(NO3)3.
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
常见除杂的方法:
CO2(O2):将气体通过灼热的铜网
CO2(H2或CO):将气体通过灼热的氧化铜
O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂
O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中
Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤
Fe(含Cu):用磁铁将铁粉吸引出来
Cu(含CuO),Fe(含Fe2O3):高温下与H2或CO反应
CuO(含Cu或C):在空气中灼烧
CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2)
CaCO3(含CaO):加足量水溶解,过滤,取滤渣
Ca(OH)2(含CaO)加足量水
FeSO4溶液(含H2SO4或CuSO4),FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液
NaCl溶液(含Na2CO3):加适量稀盐酸
Na2SO4溶液(含CuSO4):加适量 NaOH 溶液
酸、碱、盐溶液的除杂技巧:
1.被提纯物与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去Na2SO4溶液中的NaOH:可选用稀H2SO4溶液为除杂试剂(2NaOH+ H2SO4==Na2SO4+2H2O)、除去KCl溶液中的 K2SO4:可选用BaCl2溶液为除杂试制(K2SO4+BaCl2 ==2KCl+BaSO4↓,过滤除去)
2.被提纯物与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂,如除去NaCl溶液中的BaCl2:可选用 Na2SO4溶液为除杂试剂(BaCl2+Na2SO4=BaSO4↓ +2NaCl,过滤除去).再如除去KNO3溶液中的AgNO3:可选用KCl溶液为除杂试剂(AgNO3+KCl=AgCl↓ +KNO3,过滤除去)。
3.被提纯物质与杂质所含阴离子、阳离子都不相同时,应选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如:除去NaCl溶液中的CuSO4:可选用Ba(OH)2溶液为除杂试剂[CuSO4+Ba(OH)2= BaSO4↓+Cu(OH)2↓,过滤除去]。
分离和提纯的方法:
物质的分离和提纯有两种主要的方法,即物理方法和化学方法。实际上在实验过程中往往需通过综合法来进行。
(1)物理方法主要包括过滤,蒸馏,结晶
| 方法 | 适用范围 | 举例 | 注意事项 |
| 过滤 | 分离不溶性固体和液体 | 粗盐提纯 | ①过滤时要“一贴、二低,三靠”; ②必要时要洗涤沉淀物 |
| 结晶 | 利用混合物中各组分在某种溶剂中溶解度随温度变化不同的性质来分离提纯物质 | 分离氯化钠和硝酸钾混合物 | ①一般先配较高温度下的浓溶液,然后降温结晶: ②结晶后过滤,分离出晶体 |
| 蒸馏 | 沸点不同的液体混合物 | 石油的分馏 | ①温度计水银球在蒸馏烧瓶的支管口处; ②加沸石(或碎瓷片); ③冷凝管水流方向 |
(2)化学方法
| 除杂方法 | 除杂原理 | 应用实例 |
| 化气法 | 与杂质反应生成气体而除去 | 除Na2SO4中的NaCO3,可加适量稀盐酸 NaCO3+H2SO4==Na2SO4+CO2↑+H2O |
| 沉淀法 | 将杂质转化为沉淀过滤除去 | 除去NaCl中的Na2SO4.可加适量的BaCl2 Na2SO4+BaCl2==BaSO4↓+2NaCl |
| 置换法 | 将杂质通过置换反应而除去 | c除去FeSO4中的CuSO4可加过量的铁粉 CuSO4+Fe==Cu+FeSO4 |
| 溶解法 | 将杂质溶丁某种试剂而除去 | 除C粉中的CuO粉末,可加适量稀盐酸,再过滤 CuO+H2SO4==CuSO4+H2O |
| 加热法 | 杂质受热易分解,通过加热将杂质除去 | 除CaO中的CaCO3可加热 CaCO3  CaO+CO2↑ CaO+CO2↑ |
| 转化法 | 将杂质通过化学反应转化为主要成分 | 除去CO2中的CO,可将气体通过灼热的CuO CO+CuO  Cu+CO2 Cu+CO2 |
(3)综合法
在进行混合物的分离或提纯时,采用一种方法往往不能达到目的,而要采用几种方法才能完成,这就是综合法。综合法主要有三种:
①物理方法的综合:主要是溶解、过滤、蒸发、结晶等方法的结合:
②化学方法的综合:当某物质所含杂质不止一种时,通常需加入多种试剂除去(或分离)不同的物质。
③物理与化学方法的综合:当某物质所含杂质不止一种,且有能用物理方法除去(或分离)的杂质时,首先应考虑用物理方法除去一种或几种杂质,然后再用化学方法除去其余杂质。
(4)除杂方法的几个优化原则
①若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
②应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
③先考虑物理方法,再用化学方法。
常见的混合物类型及分类与提纯的方法见下表:
| 混合物类型采用的方法 | 物理方法 | 化学方法 | |
| 固—固混合 | 可溶—可溶 | 结晶 | 把杂质变成沉淀、气体等除去 |
| 可溶—不溶 | 过滤 | —— | |
| 不溶—不溶 | — | 把杂质变成可溶物除去 | |
| 固—液混合 | 过滤 | —— | |
| 液—液混合 | —— | 把杂质变成沉淀,气体或被提纯物 | |
| 气—气混合 | —— | 把杂质变成固体、溶液或被提纯物 | |
发现相似题
与“某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:(1...”考查相似的试题有:
- 2008年春节前,我国南方数省遭受雪灾袭击,为及时消除道路积雪,人们将融雪剂撒在路面上,以便尽快融化路面上的积雪,防止路...
- 过氧乙酸(CH3COOOH)是一种常用消毒剂,目前广泛用于环境消毒.过氧乙酸由______种元素组成,其中C、H、O元素的原子个数比为...
- 在溶解和配制溶液时,下列仪器中需选用的是( )A.集气瓶B.烧杯C.蒸发皿D.漏斗
- 将80 g 10%的NaOH溶液与20 g 15%的NaOH溶液混合,混合溶液中溶质的质量分数为( )A.13%B.12%C.11%D.16%
- 除去下列杂质,所用试剂和方法不正确的是( )编 号物 质杂质(少量)试 剂方 法ACuOKNO3水过滤BFeSO4溶液CuSO4过量铁粉过滤C...
- 有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.可供选用的物质有:Ca(OH)2溶...
- 为了除去用粗盐配制成的NaCl溶液中所含有的少量MgCl2、CaCl2和MgSO4杂质,某同学从碳酸钠溶液、稀盐酸、硝酸钡溶液、碳酸钾溶...
- 下列各组物质中,括号内为除杂的试剂,能达到除杂目的是( )A.CuCl2溶液中混有FeCl2(铁粉)B.NaNO3溶液中混有Na2SO4(BaC...
- 分离下列各组物质的方法不正确的是[ ]A.用过滤的方法分离CuO和CuSO4的混合物B.用结晶法分离NaCl和KNO3的混合物C.用通过灼...
- 要检验生石灰中是否混有石灰石,可加__________,若要除去生石灰中的石灰石,可采用的方法为_______________________________...