本试题 “下列反应中都有水参与,是氧化还原反应的,指出水是氧化剂还是还原剂,或既不是氧化剂又不是还原剂;属于四种基本反应类型的,指出其反应的类型。(1) 2Na+2H2...” 主要考查您对氧化剂、还原剂
氧化还原反应的定义
分解反应
置换反应
复分解反应
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化剂、还原剂
- 氧化还原反应的定义
- 分解反应
- 置换反应
- 复分解反应
(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:
①活泼非金属单质:如 Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如 浓H2SO4、HNO3、HClO等
④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等
还原剂:
(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:
①活泼金属单质:如 Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;
③某些非金属单质:如 H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如 H2S、HCl、HI、NH3等 。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
常见的氧化剂及对应的还原产物:
|
氧化剂 |
还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
|
还原剂 |
氧化产物 |
|
Na、K等金属单质 |
Na+、K+ |
|
某些非金属C、S |
CO2、SO2 |
|
非金属的氢化物CH4、H2S、NH3等 |
CO2、S/SO2、NO |
|
某些低价态的氧化物CO、SO2 |
CO2、SO3 |
|
某些低价态的酸或盐H2SO3、Na2SO3等 |
SO42- |
|
某些低价态的阳离子Fe2+ |
Fe3+ |
|
H2O2 |
O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 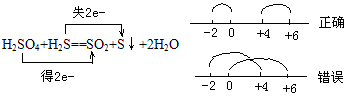
氧化还原反应:
有电子转移(得失或偏移)的反应;(无电子转移(得失或偏移)的反应为非氧化还原反应)
反应历程:
氧化还原反应前后,元素的氧化数发生变化。根据氧化数的升高或降低,可以将氧化还原反应拆分成两个半反应:氧化数升高的半反应,称为氧化反应;氧化数降低的反应,称为还原反应。氧化反应与还原反应是相互依存的,不能独立存在,它们共同组成氧化还原反应。
氧化还原反应中存在以下一般规律:
强弱律:氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
转化律:同种元素不同价态间发生归中反应时,元素的氧化数只接近而不交叉,最多达到同种价态。
优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化还原性的强弱判定:
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
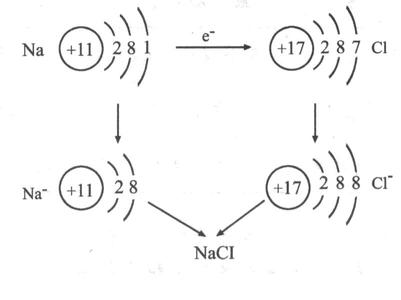
电子的得失过程:

其过程用核外电子排布变化情况可表示为:
分解反应:
一种化合物在特定条件下(如加热、通直流电、催化剂等)分解成两种或两种以上较简单的单质或化合物的反应
分解反应类型:
氧化物分解: 2H2O=(通电)2H2↑+O2↑ 2H2O2=(MnO2)2H2O+O2↑
含氧酸分解: H2CO3=(△)H2O+CO2↑ H2SO3=(△)H2O+SO2↑
碱的分解: Mg(OH)2=(高温)MgO+H2O Cu(OH)2=(△)CuO+H2O 2Fe(OH)3=(高温)Fe2O3+3H2O
2Al(OH)3=(高温)Al2O3+3H2O (注:不溶性碱高温时可分解为金属氧化物和水)
盐的分解: 2NaHCO3=(△)Na2CO3+CO2↑+H2O Ca(HCO3)2=(△)CaCO3+CO2↑+H2O CaCO3=(高温)CaO+CO2↑
2KMnO4=(△)K2MnO4+MnO2+O2↑ 2KClO3=(△,MnO2)2KCl+3O2↑
分解反应的模型:
A=B+C 可以简单理解为“一变多”,也可以理解成为由一种反应物发生化学反应后生成两种或两种以上的物质的反应。
分解反应与氧化还原反应的关系:
分解反应不一定是氧化还原反应,例如:2Al(OH)3=(高温)Al2O3+3H2O
只有能产生单质的分解反应才是氧化还原反应,例如:2H2O=(通电)2H2↑+O2↑
置换反应:
单质与化合物反应生成另外的单质和化合物的化学反应
发生置换反应的原理:
必须是活动性强的金属置换活动性弱的金属或H+溶液
根据元素性质分类:
1.金属单质置换金属单质:2Al+Fe2O3=高温=Al2O3+2Fe(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换);Fe+CuSO4=FeSO4+Cu
2.金属单质置换非金属单质:Zn+2HCl=H2↑+ZnCl2 ;2Na+2H2O=2NaOH+H2↑;2Mg+CO2=点燃=2MgO+C;3Fe+4H2O(g)=高温=Fe3O4+4H2
3.非金属单质置换金属单质:H2+CuO=Δ=Cu+H2O ;C+FeO=Δ=Fe+CO↑
4.非金属单质置换非金属单质:2F2+2H2O=4HF+O2 ;2C+SiO2=Si+2CO↑ ;C+H2O=高温=CO+H2 ;2H2+SiCl4=Si+4HCl ;Cl2+2NaBr=Br2+2NaCl
置换反应与氧化还原反应的关系:
置换反应一定属于氧化还原反应。
复分解反应的定义:
复分解反应是由两种化合物,通过互相交换成分并生成两种新化合物的反应,模式为AB+CD→AD+CB。它是基本类型的化学反应之一。复分解都不是氧化还原反应。
复分解反应发生的条件:
1.生成难溶的物质:如生成BaSO4、AgCl、CaCO3等沉淀。
2.生成气体或易挥发物质:如生成CO2、H2S等气体。
3.有弱电解质生成:如生成H2O、弱酸、弱碱等。
复分解反应的分类:
- 酸与盐 例如:2HCl+CaCO3=CaCl2+H2O+CO2↑
- 酸与碱 例如:H2SO4+Ba(OH)2=BaSO4↓+2H2O
- 盐与盐(可溶) 例如:Na2CO3+CaCl2=2NaCl+CaCO3↓
- 盐与碱 例如:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
- 酸与金属氧化物 例如:盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
复分解反应的模型:
AB+CD→AD+CB
复分解反应与氧化还原反应的关系:
复分解都不是氧化还原反应。
与“下列反应中都有水参与,是氧化还原反应的,指出水是氧化剂还...”考查相似的试题有:
- (1)以黄铜矿冶炼金属铜的过程中发生反应:2Cu2O+Cu2S6Cu+SO2↑,反应的氧化剂是_________。(2)黄铜矿熔炼后得到的粗铜含少量...
- 铁和水蒸气在高温条件下发生反应3Fe+4H2O(g)Fe3O4+4H2,在此反应中水是[ ]A.氧化剂B.还原剂C.既是氧化剂又是还原剂D.既不...
- 标明下列各反应的电子转移情况,指出氧化剂和还原剂。(l)CO2+C2CO_______________(2)2Fe2O3+3C4Fe+3CO2↑______________(3)2H2...
- 常温下,pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol/L的碘酸( HIO3)或高锰酸(HMnO4)溶液...
- 亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:_____Na2SO3+____KIO3+____ H2SO4=____Na2SO4+_____K2SO4+____ I2+_____H2O(1)配...
- 铜的冶炼大致可分为:(1)富集,将硫化物矿进行浮选;(2)焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);(3)制...
- 下列变化中,需加入适当的氧化剂才能完成的是( )A.Fe→FeCl2B.CuO→CuC.SO3→H2SO4D.HNO3→NO
- 下列叙述正确的是( )A.有单质生成的反应一定是氧化还原反应B.氧化还原反应的本质是化合价发生变化C.还原剂就是反应中被...
- 下列反应中必须加入氧化剂才能进行的是( )A.KClO3→O2B.Cu2+→CuC.Fe2+→Fe3+D.CuO→CuCl2
- 在下列反应中,水仅作还原剂的是( )A.Na2O+H2O═2NaOHB.2F2+2H2O═4HF+O2C.Cl2+H2O═HCl+HClOD.2H2O电解.2H2↑+O2↑