本试题 “下列说法正确的是( )A.0.5molO3,与11.2 LO2所含的分子数一定相等B.25℃与60℃时,水的pH相等C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H...” 主要考查您对气体摩尔体积
焓变、反应热
水电离的影响因素
水的电离平衡
溶解度的计算
溶液pH的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 气体摩尔体积
- 焓变、反应热
- 水电离的影响因素
- 水的电离平衡
- 溶解度的计算
- 溶液pH的有关计算
气体摩尔体积:
单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol(L·mol-1)、m/mol(m·mol-1)
计算公式: 气体摩尔体积(Vm)=气体体积(V)/物质的量(n)
标况下(0℃ 101kPa)气体摩尔体积约为22.4L/mol,在25℃和101kPa条件下,气体摩尔体积约为24.5L/mol。
气体摩尔体积的使用方法:
- 在非标准状况下,不能用气体摩尔体积22.4mol/L进行计算。
- 标准状况下,非气体(即固、液体)不能用气体摩尔体积22.4mol/L进行计算。
- 气体可以是纯净气体,也可以是混合气体。
决定物质体积大小的因素:
- 粒子数目的多少
- 粒子本身的大小
- 粒子之间的平均距离
决定固体、液体物质的体积大小的因素主要是粒子数目的多少和粒子本身的大小;而气体的体积大小的决定因素是粒子数目的多少和分子间的平均距离。
标准状况下,气体摩尔体积的5个“关键”:
- 关键字——气体:研究对象是气体,非气体不研究摩尔体积。
- 关键字——任何:任何气体,只要是气体,不管纯净物还是混合物,只要状态相同,物质的量相同,体积就相同。
- 关键字——标况:标况下气体摩尔体积一定是Vm=22.4L/mol,非标准状况下的气体不一定等于22.4L/mol。
- 关键字——约为:22.4只是个约数,不是准确值,因为对于气体,忽略了粒子的大小对体积的影响,所以在相同的条件下。气体的摩尔体积近似相等。
- 关键字——1mol:气体在标况下的体积约为22.4L所对应的物质的量为1mol。
标准状况:
在0℃和101kPa的条件下,1mol任何气体的体积都约为22.4L。温度为0℃、压强为101kPa时的状况,我们通常称为“标准状况”。
在标准状况下,气体的摩尔体积约为22.4L/mol。
问题探究:
标准状况下,1mol气体的体积是22.4L,如果当1mol气体的体积是22.4L时,一定是标准状况吗?
答:不一定,因为影响气体体积的因素是温度、压强两个条件,非标准状况下1mol气体的体积也可能是22.4L。
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
影响水电离平衡的因素:
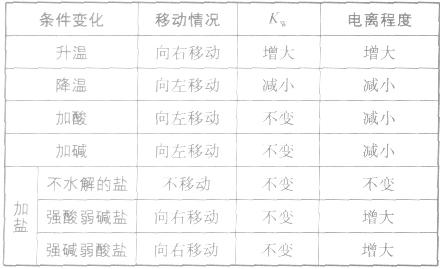
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液)
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
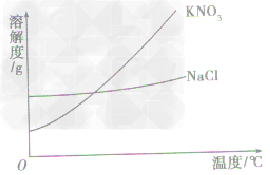
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
溶液pH的计算方法:
总体原则
(1)若溶液为酸性,先求C(H+),再求pH;
(2)若溶液为碱性,先求C(OH-),再由 ,最后求pH。
,最后求pH。
1.单一溶液pH的计算
(1)强酸溶液,如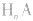 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为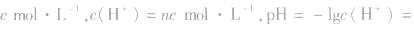
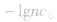
(2)强碱溶液,如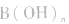 溶液,设溶质的物质的量浓度为
溶液,设溶质的物质的量浓度为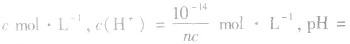
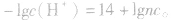
2.两强酸混合后pH的计算
由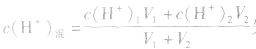 先求出混△后的
先求出混△后的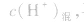 再根据公式
再根据公式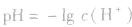 求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
求pH。若两强酸溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH小的加0.3。如pH=3和pH=5的盐酸等体积混合后,pH=3.3。
3.两强碱混合后pH的计算
由 先求出混台后的
先求出混台后的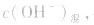 再通过
再通过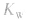 求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
求出混合后的c(H+),最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的烧碱溶液等体积混合后, pH=10.7。
4.强酸与强碱混合后pH的计算
强酸与强碱混合的实质是中和反应即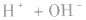
 中和后溶液的pH有以下几种情况:
中和后溶液的pH有以下几种情况:
(1)若恰好中和,pH=7。
(2)若剩余酸,先求中和后的c(H+),再求pH。
(3)若剩余碱,先求中和后的c(OH-),再通过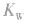 求出
求出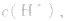 最后求pH.
最后求pH.
注意:强酸与强碱等体积混合后溶液酸碱性的判断规律:
①若二者pH之和为14,则混合后的溶液呈中性, pH=7
②若二者pH之和大于14,则混合后的溶液呈碱性
③若二者pH之和小于14,则混合后的溶液呈酸性,
5.溶液稀释后求pH
(1)对于强酸溶液,每稀释10倍体积,pH增大1 个单位;对于弱酸溶液,每稀释10倍体积,pH增大不足一个单位。无论稀释多少倍,酸溶液的pH不能等于或大于7,只能趋近于7。
(2)对于强碱溶液,每稀释10倍体积,pH减小1 个单位;对于弱碱溶液,每稀释10倍体积,pH减小不足一个单位。无论稀释多少倍,碱溶液的pH不能等于或小于7,只能趋近于7。
例如:pH=6的HCl溶液稀释100倍,溶液pH≈7 (不能大于7);
pH=8的NaOH溶液稀释100倍,溶液pH≈7(不能小于7):
pH=3的HCl溶液稀释100倍,溶液pH=5;
pH=10的NaOH溶液稀释100倍,溶液pH=8。
注意:弱酸、弱碱的稀释:在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范同。
例如:pH=3的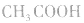 溶液稀释100倍,稀释后
溶液稀释100倍,稀释后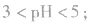
pH=10的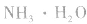 溶液稀释100倍,稀释后8<
溶液稀释100倍,稀释后8<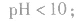
pH=3的酸溶液稀释100倍,稀释后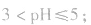
pH=10的碱溶液稀释100倍,稀释后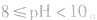
与“下列说法正确的是( )A.0.5molO3,与11.2 LO2所含的分子数...”考查相似的试题有:
- 下列说法中错误的是( )A.物质燃烧可看成“储存”在物质内部的能量转化为热能、光能等形式释放出来B.绿色植物进行光合作用时...
- 常温下,若HA溶液和NaOH溶液混合后pH =7,下列说法不合理的是 ( )A.反应后HA溶液可能有剩余B.生成物NaA的水溶液的pH可能...
- 常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(...
- 下列溶液中各微粒的浓度关系一定正确的是( )A.某酸性溶液中只含NH、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(...
- 水的电离方程为H2OH++OH—,在不同的温度下,其平衡常数K(25℃)=1×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是:A.c(H...
- Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n(): n()变化的关系如下表:n(): n()91:91:19:91pH8.27.26.2 以下离子浓度关系的判...
- 下列叙述正确的是A.氨水是强碱B.含金属元素的离子不一定是阳离子C.凡能电离出H+的化合物均属酸D.盐类物质一定含有金属阳...
- 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是 ( )A.a<7时,溶液的pH一定为aB.a>7时,溶...
- 在48mL0.1mol/LHNO3溶液中加入12mL0.4mol/LKOH溶液时,所得到的溶液呈A.弱酸性B.强酸性C.碱性D.中性
- 下列说法错误的是( )A.常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得pH≠7,则混合溶液的pH>7B.在Na2S中存在...