本试题 “下列热化学方程式正确的是(注:△H的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) B.NaOH(aq)+HCl(aq...” 主要考查您对热化学方程式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 热化学方程式
热化学方程式:
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如: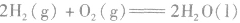 :
: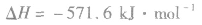 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。例如:
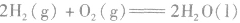 :
: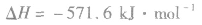 ,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。
,表示在25℃、101kPa下,2molH2(g)和1mol O2(g)完全反应生成2molH2O(l)时要释放571.6kJ 的能量。热化学反应方程式的书写:
热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:
1.注意△H的符号和单位 △H只能写在标有反应物和生成物状态的化学方程式的右边。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数
(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
发现相似题
与“下列热化学方程式正确的是(注:△H的绝对值均正确)( ) A....”考查相似的试题有:
- 如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是[ ]A.1 mol H2中的化学键断裂时...
- 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol②CH3O...
- 已知:在热力学标准态(298K、1.01×105 Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧...
- 2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷,悉尼奥运会火炬所用燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为:2221...
- 今有如下三个热化学方程式:H2(g)+1/2O2(g) ==H2O(g) ;△H1H2(g) + 1/2O2(g) == H2O(l) ;△H22H2(g)+O2(g)==2H2O(g) ;△H3H2O...
- (1)氮的氢化物肼(N2H4)是航天火箭发射常用的燃料①发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气...
- 汽车工业是世界上仅次于石油化工的第二大产业,传统汽车不仅消耗大量的石油资源,而且造成了严重的大气污染,汽车工业正积极...
- 下列说法正确的是[ ]A.等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多B.植物通过光合作用将二氧化碳转化为葡萄...
- 丙烷、丁烷是重要的化工产品。请按要求回答相关问题:(1)已知正丁烷的燃烧热为2 878 kJ·mol-1,异丁烷的燃烧热为2 869.6 kJ·m...
- 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。(1)下图是N2与H2反应过程中能量变化的示意图,则该反应的热...