本试题 “下列说法正确的是[ ]A.ΔH0的反应在温度低时不能自发进行B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混...” 主要考查您对熵;熵变
化学反应进行的方向
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 熵;熵变
- 化学反应进行的方向
自发过程与自发反应:
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
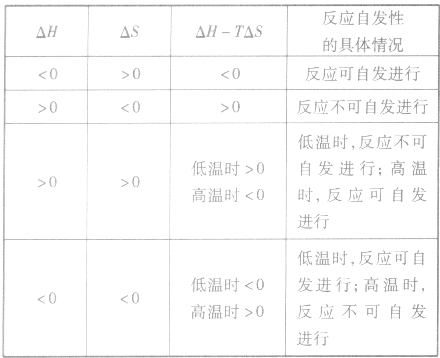
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是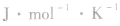 。
。
△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是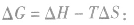
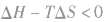 反应能自发进行
反应能自发进行
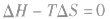 反应达到平衡状态
反应达到平衡状态
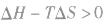 反应不能自发进行
反应不能自发进行
在一定温度和压强下,无需外界帮助就能自动进行的过程叫做自发过程;在一定温度和压强下,无需外界帮助就可以自发进行到显著程度的化学反应叫自发反应。
化学反应方向的判据:
1.焓变对反应方向的影响:
△H<0 的化学反应也能自发进行。但有些△H>0的化学反应也能自发进行,也就是说,焓变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素:
2.熵与熵变:
熵是用于描述体系混乱度的物理量,以符号S表示。熵值越大,体系的混乱度越大。
在一定条件下,不同物质的熵值不同;对同一物质来说,S(g)>S(l)>S(s),S(aq)>S(s)。
物质发生化学反应后熵值也发生变化,这个熵值的变化叫做反应的熵变,以符号△S表示,单位是
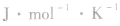 。
。△S=生成物总熵一反应物总熵
若△S为正值,表示反应过程中熵值增大,称为熵增过程;若△S为负值,表示反应过程中熵值减小,称为熵减过程。在与外界隔离的体系中,自发过程将导致体系的熵值增大,这个原理也叫做熵增原理。
3.熵变对反应方向的影响:
△S>0有利于化学反应的自发进行,有些△S>0 的化学反应在常温下不能自发进行,但在较高温度下可以自发进行,有些△S<0的化学反应也能自发进行。总之,熵变是与化学反应能否自发进行有关的一个重要因素,但不是唯一的因素。
4.焓变与熵变对反应方向的共同影响:
在温度和压强一定的条件下,化学反应的方向是反应的焓变和熵变共同影响的结果,反应方向的判据是
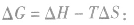
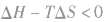 反应能自发进行
反应能自发进行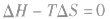 反应达到平衡状态
反应达到平衡状态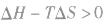 反应不能自发进行
反应不能自发进行化学反应的方向与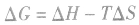 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性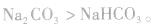
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如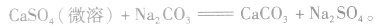
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: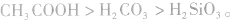
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: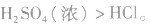
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如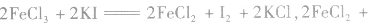
 ,则氧化性:
,则氧化性: 。
。
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向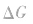
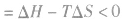 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;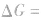
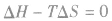 表明反应已达到平衡状态;
表明反应已达到平衡状态;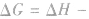
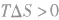 表明反应不能自发进行。
表明反应不能自发进行。
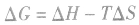 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性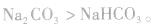
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
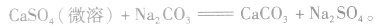
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: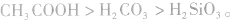
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: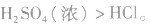
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
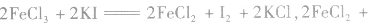
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
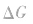
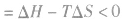 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;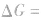
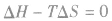 表明反应已达到平衡状态;
表明反应已达到平衡状态;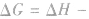
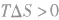 表明反应不能自发进行。
表明反应不能自发进行。
发现相似题
与“下列说法正确的是[ ]A.ΔH0的反应在温度低时不能自发进行B.N...”考查相似的试题有:
- 下列说法正确的是[ ]A.放热反应的焓变小于零,熵变大于零B.放热及熵增加的反应,一定能自发进行C.放热反应的焓变大于零,...
- 下列说法中正确的是( ) A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 B.升高NH4Cl溶液的温度,其水的离子积常数...
- 硫酸是一种重要的化工产品,2SO2+O22SO3是生产过程中的重要反应.下列对于该反应的说法中正确的是( )A.只要选择适宜的条件...
- 下列变化过程不可逆的有( )A.酯的水解B.醋酸的电离C.蛋白质的盐析D.蛋白质的变性
- 对于①需加热才发生的反应、②放热反应、③熵增加的反应,可能属于自发反应的是A.只有②B.只有③C.只有②③D.①②③
- 下列反应中,在高温下不能自发进行的是[ ]A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g)B.2N2O5(g)=4NO2(g)+O2(g)C.MgCO3(s)=MgO(...
- 对于汽车尾气的净化反应:2NO (g)+2CO(g)=N2(g)+2CO2(g)ΔH=-113.0 kJ·mol-1 ΔS=-145.3 J·mol-1·K-1,在298K、10...
- 下列关于冰熔化为水的过程判断正确的是A.△H>0,△S>0B.△H<0,△S>0C.△H>0,△S<0D.△H<0,△S<0
- 下列说法正确的是( )A.凡是放热反应都是自发的,因为吸热反应都是非自发的B.熵增加的放热反应一定能自发进行C.自发反应...
- 下列反应中属于可逆反应的是( )A.2H2+O22H2OB.6CO2+6H2OC6H12O6+6O2C.Pb+PbO2+2H2SO42PbSO4+2H2OD.C+O22CO(炼铁炉中)