本试题 “(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。A.9 B.13 C.11~13之间 D.9~11之间(2)25℃时,向0.1mol/L的氨水中加入少量氯化...” 主要考查您对水的离子积常数
水电离的影响因素
水的电离平衡
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水的离子积常数
- 水电离的影响因素
- 水的电离平衡
水的电离:
水是一种极弱的电解质,它能微弱地电离:
实验测得:25℃时,1L纯水中只有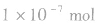 的水分子发生电离,故25℃时纯水中
的水分子发生电离,故25℃时纯水中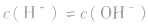

水的离子积:
在一定温度下,水电离出的c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号 表示,即
表示,即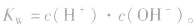
(1)在一定温度下,水的离子积都是一个常数,在25℃时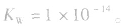
(2)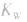 随温度的变化而变化,温度升高,
随温度的变化而变化,温度升高,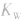 增大。
增大。
(3)水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有 存在。在酸性或碱性的稀溶液中,当温度为25℃时,
存在。在酸性或碱性的稀溶液中,当温度为25℃时,
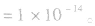
(4)在酸或碱的稀溶液中,由水电离出的c(H+)和c(OH-)总相等.即 如25℃时
如25℃时 或NaOH溶液中,
或NaOH溶液中,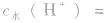
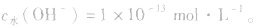
溶液中c(H+)或c(OH-)的计算:
常温下,稀溶液中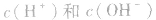 的乘积总是
的乘积总是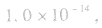 知道
知道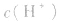 就可以计算出
就可以计算出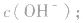 反之亦然
反之亦然
1.酸溶液
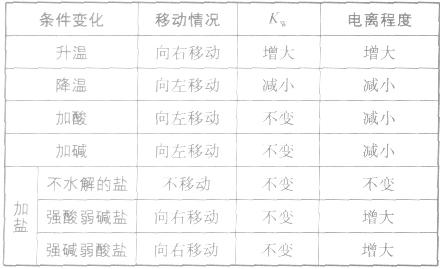
当在水中加入酸后,将使水的电离平衡向左移动 (抑制水的电离)。在酸的水溶液中,H+主要由酸电离产生,即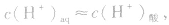 而OH-是由水电离产生的:
而OH-是由水电离产生的: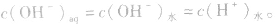
2.碱溶液
同理,在碱的水溶液中,OH-主要由碱电离产生,即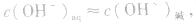 而H+是由水电离产生的:
而H+是由水电离产生的: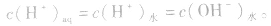
3.盐溶液
在盐的水溶液中,H+和OH-全部来自水的电离,且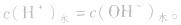
(1)若单一水解的盐的水溶液呈酸性,c(H+)> c(OH-),即弱碱阳离子水解


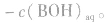
(2)若单一水解的盐的水溶液呈碱性,c(OH一)> c(H+),即弱酸阴离子水解
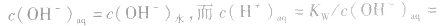
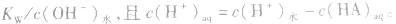
说明:由以上分析可以看出,在常温下(25℃):
酸(或碱)的溶液中,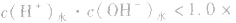
 发生水解的盐溶液中
发生水解的盐溶液中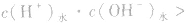
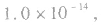 但
但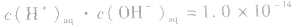 总成立。
总成立。
影响水电离平衡的因素:
水的电离:
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
发现相似题
与“(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序...”考查相似的试题有:
- 下列关于电解质电离的叙述中,正确的是A.碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质B.碳酸钙在水...
- 随着环保意识的增强,清洁能源越来越受人们关注。(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源。...
- 有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成: ①与②与NaOH ③与 ④与,下列各项排序正确的是A.pH:②>③>④>①B.:②>④...
- 下列说法正确的是( )A.强电解质都是离子化合物,而弱电解质都是共价化合物B.中和PH值相等、体积相等的盐酸和醋酸,盐酸所...
- 下列叙述中正确的是A.加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3B.将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降...
- 下列说法正确的是A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到...
- 在Na2S溶液中存在的下列关系不正确的是( )A.=2[++]B.+=++C.=++2D.>>>
- 下列说法正确的是( ) A.在某温度下,测得纯水中c(H+)=2×10-7mol/L,则c(OH-)为5×10-8mol/L B.CH3COOH溶液与NaOH溶液...
- 水能“分裂”出一个质子而离解,此处打引号是由于分裂出来的质子不是以游离态存在于真实的化学体系中,而是立即与另一水分子结...
- 已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积KW=1.0×10-12mol2·L-2。下列说法中正确的是A.0.05 mol·L-...