本试题 “某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表,下列说法错误的是( ) 物质 X Y Z W 初始浓度/mol•L-1 0.5 0.6 0 0 平衡浓度/mol•L-1 0....” 主要考查您对勒夏特列原理
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 勒夏特列原理
- 化学平衡的有关计算
原理内容:
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)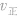 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有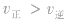 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。
(3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:
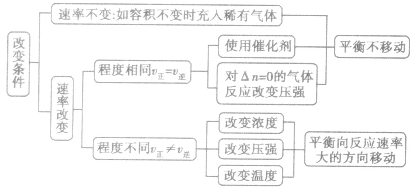
如果改变影响平衡的一个条件(如浓度、压强、温度),平衡将向着能够减弱这种改变的方向移动。勒夏特列原理又叫平衡移动原理。
适用范围:
平衡移动原理适用于化学平衡、溶解平衡、电离平衡、水解平衡等动态平衡。
注意事项:
(1)平衡向“减弱”外界条件变化的方向移动,但不能“抵消”外界条件的变化。
(2)
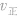 增大并不意味着平衡一定向正反应方向移动,只有
增大并不意味着平衡一定向正反应方向移动,只有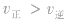 时才可以肯定平衡向正反应方向移动。
时才可以肯定平衡向正反应方向移动。 (3)当平衡向正反应方向移动时,反应物的转化率并不一定提高,生成物的体积分数也并不一定增大(因为反应物或反应混合物的总量增大了),增大一种反应物的浓度会提高另一种反应物的转化率。
(4)存在平衡且平衡发生移动时才能应用平衡移动原理。
分析思路:

化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
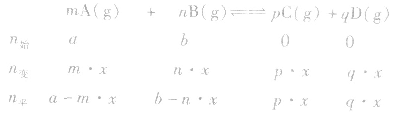
则有:

(2)对于反应物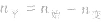 ,对于生成物
,对于生成物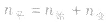
(3)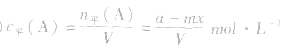
(4)A的转化率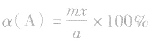
(5)平衡时A的体积(物质的量)分数
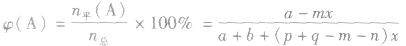
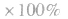
(6)
(7)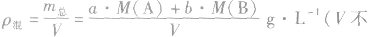
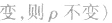
(8)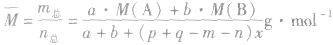
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
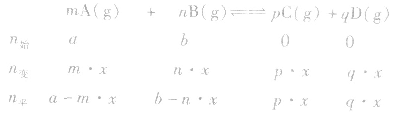
则有:

(2)对于反应物
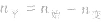 ,对于生成物
,对于生成物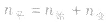
(3)
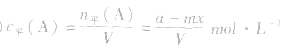
(4)A的转化率
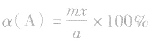
(5)平衡时A的体积(物质的量)分数
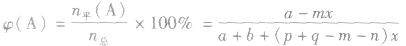
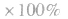
(6)

(7)
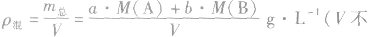
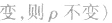
(8)
发现相似题
与“某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓...”考查相似的试题有:
- 对可逆反应:A(g)+3B(g) 2C(g) ?H
- 一定温度下向某容积固定的密闭容器中加入2mol A和1mol B,发生如下反应:2A(g)+B(g)⇌3C(g)+D(s)△H=-Q kJ•mol.1(Q>...
- 在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入1 L含3 mol H2和1 mol N2的混合气体,反应达平衡时有...
- 一定条件下,反应,下列哪一种状态可能没有达到化学反应限度: A.速率比:V(NO2):V(NO):V(O2)=2:2:l时的状态B.混合气体...
- 恒温下,在容积为2L的密闭容器中发生3A(g)+2B(g)⇌2C(g)+xD (s)反应,若起始投料为3molA、2molB,2min达平衡,生成D1....
- 可逆反应P(g)+Q(g) R(g)+S(g)在体积和温度不变的密闭容器中进行。下列事实中,可作为反应达到化学平衡状态的标志的是。A.单...
- 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:(1...
- 在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B) =0. 200 mol/L及c(C) =0 mol/L...
- 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:温 度(℃...
- 在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6mol...