本试题 “(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:(1)写出铝片与盐酸、硫酸反应的离子方程式 (2)反应1~15min内,...” 主要考查您对影响化学反应速率的因素
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学反应速率的因素
影响化学反应速率的因素:
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为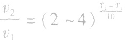
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释
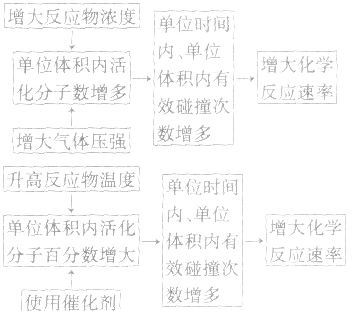
1.内因:参加反应的物质的结构及性质。
2.外因:主要是指浓度、温度、压强和催化剂,另外还有光、超声波、激光、搅拌、固体表面积、形成原电池等。
(1)浓度:其他条件相同时,增大反应物浓度,化学反应速率增大;减小反应物浓度,化学反应速率减小。在一定温度下,同体、纯液体的浓度视为定值,如C与CO2的反应、Na与H2O的反应中,C的量和Na、H2O 的量减少并不意味着其“浓度”减小,即不冈其量的增减而影响反应速率,但会因固体表面积的变化而改变反应速率。
(2)温度:其他条件相同时,升高温度,可以加快反应速率,实验测得,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
经验公式为
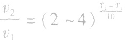
(3)压强:对于气体反应,当温度不变时,增大压强可以加快反应速率。对于气体反应体系,压强改变时有以下几种情况:

(4)催化剂:催化剂是能改变化学反应速率但在反应前后本身的质量和化学性质都不变的物质。对于某些化学反应,使用正催化剂能显著加快化学反应速率。
(5)其他因素:增大同体的表面积(如将块状改为粉末状),可增大反应速率;光照一般也可增大某些反应的速率;形成原电池可以加快反应速率;此外,超声波、放射线、电磁波等因素也能影响反应速率。
3.外因对化学反应速率影响的微观解释

发现相似题
与“(9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反...”考查相似的试题有:
- 少量铁粉与100ml 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的[ ]①加H2...
- 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0下列分析中正确的是( )A.图Ⅰ研究中的是t0时...
- 下列说法合理的是( )A.增加反应物的用量,化学反应速率一定加快B.在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出Ag...
- 下列说法错误的是( )A.碳酸钙受热分解是吸热反应B.燃料的燃烧反应都是放热反应C.升高温度可以加快反应速率D.乙烷、乙烯...
- 下列说法不正确的是( )A.溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜B.仅用新制的氢氧化铜悬浊液一...
- 下述实验不能到达预期目的的是编号实验内容实验目的A向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加...
- 入大量SO3 D.降低体系温度
- 体积相同的甲、乙两个容器中,分别都充有等物质的量的NH3,在相同温度下发生反应:2NH3N2+3H2,并达到平衡。在这个过程中,...
- 工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)⇌2NH3(g)反应的图象中,错误的是( )A.B.C.D.
- 下列措施能减慢化学反应速率的是A.将煤块粉碎后燃烧B.用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气C.用过氧化氢溶液制氧气...