本试题 “下列说法正确的是( )A.硅肺病又称矽肺病,它是一种职业病,是人们长期吸入硅粉尘引起的B.硝酸纤维、醋酸纤维以及常见的“六大纶”如腈纶、丙纶等都是化学合...” 主要考查您对单质硅
二氧化硅
合成有机高分子化合物
煤的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质硅
- 二氧化硅
- 合成有机高分子化合物
- 煤的综合利用
硅:
①元素符号:Si
②原子结构示意图: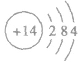
③电子式: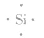
④周期表中位置:第三周期ⅣA族
⑤含量与存在:在地壳中的含量为26.3%,仅次于氧,在自然界中只以化合态存在
⑥同素异形体:晶体硅和无定形硅
硅的物理性质和化学性质:
(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料。 (2)化学性质:化学性质不活泼
①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应 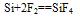
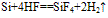 (雕刻玻璃)
(雕刻玻璃)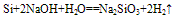
②在加热条件下,能与氧气、氯气等少数非金属单质化合
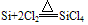
(4)制备:在电炉里用碳还原二氧化硅先制得粗硅: ,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:
,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为: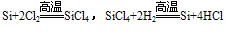 。
。
碳族元素中碳和硅的一些特殊规律:
1.金刚石和晶体硅都是原子晶体,但金刚石不导电,晶体硅能导电.且金刚石的熔点(大于3550℃)比硅的熔点(1410℃)高;石墨是过渡型晶体或混合型晶体,也能导电。
2.碳和硅都能跟O2反应生成氧化物,碳的两种氧化物CO和CO2在常温下是气体,而硅的氧化物SiO2 在常温下是固体。
3.碳跟碱溶液不反应,而硅跟碱溶液能反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
4.碳在高温时能跟水蒸气反应,而硅不能。
C+H2O(g) CO+H2
CO+H2
5.碳跟氢氟酸不反应,而硅能跟氢氟酸反应。
Si+4HF==SiF4↑+2H2↑
6.碳能被浓硫酸(或浓硝酸)氧化生成二氧化碳,但硅不能被浓硫酸(或浓硝酸)氧化。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C+4HNO3(浓) 4NO2↑+2H2O+CO2↑
4NO2↑+2H2O+CO2↑
7.碳和硅都具有还原性,且硅的还原性比碳强,但在高温时碳能把硅从SiO2中还原出来。
2C+SiO2 Si+2CO↑
Si+2CO↑
8.碳的氯化物都不能自燃,而SiH4能自燃。
SiH4+2O2==SiO2+2H2O
9.通常情况下,周态CO、CO2都是分子晶体,熔、沸点都很低;而SiO2是原子晶体,熔、沸点较高。
10.CO2溶于水且能跟水反应生成碳酸,SiO2却不能.
11.CO2跟氢氟酸不反应,而SiO2能跟氢氟酸反应.
SiO2+4HF==SiF4↑+2H2O
12.CO2跟碱溶液反嘘生成正盐或酸式盐,而SiO2 跟碱溶液反应只生成正盐。
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SiO2+2NaOH==Na2SiO3+H2O
13.在溶液中Na2SiO3可转变为Na2CO3,而在高温条件下Na2CO3又可转变为Na2SiO3。
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅及其化合物的几种反常现象:
1.Si的还原性大于C,但C却能在高温下还原出Si 可从平衡移动的角度理解,由于高温下生成了气态物质CO2它的放出降低了生成物的浓度,有利于应反正向进行,故可发生反应:SiO2+2C Si+2CO↑
Si+2CO↑
2.部分非金属单质能与碱溶液反应,但其中只有 Si与碱反应放出H2 常见的非金属单质与碱溶液的反应有:
Cl2+2NaOH==NaCl+NaClO+H2O①
3S+6NaOH 2Na2S+Na2SO3+3H2O②
2Na2S+Na2SO3+3H2O②
Si+2NaOH+H2O==Na2SiO3+2H2↑③
在反应①②中,Cl2、S既作氧化剂又作还原剂:在反应③中,Si为还原剂。
3.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还会产生H2
4.硅酸不能由相应的酸酐与水反应制得制取硅酸的实际过程很复杂,条件不同可得到不同的产物,通常包括原硅酸(H2SiO4)及其脱水得到的一系列酸。原硅酸经两步脱水变为SiO2,SiO2是硅酸的酸酐,是一种不溶于水的同体,不能直接用它制备硅酸,用SiO2制取硅酸时,可先将SiO2溶于烧碱中,再向溶液中加入足量的盐酸或通入过量的CO2,析出的胶状物就是原硅酸,将原硅酸在空气中脱水即得硅酸,反应原理可理解为:
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+CO2+2H2O==Na2CO3+H4SiO4↓
H4SiO4==H2SiO3+H2O
5.非金属氧化物的熔沸点一般较低,但SiO2的熔沸点却很高非金属氧化物一般为分子晶体,但SiO2为原子晶体。分子晶体中分子以分子问作用力相结合,而分子间作用力很弱,破坏它使晶体变为液体或气体比较容易;而在SiO2晶体中每个硅原子与四个氧原子相结合,形成硅氧四面体,在每个硅氧四面体结构单元中Si—O 键的键能很高,同时硅氧四面体结构单元可通过共用顶角氧原子连成立体网状结构,所以要使它熔融,必须消耗更多的能量,因此SiO2的熔沸点很高。
6.SiO2是酸性氧化物却能跟HF作用
SiO2+4HF==SiF4↑+2H2O,此反应并不是因为HF的酸性,而是因为为常温下SiF4为气态物质,有利于反应正向进行,这是SiO2的突出特性,当然也是HF 的特性。
7.H2CO3的酸性强于H2SiO3。但却能发生如下反应:Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
强酸制备弱酸作为判断反应方向的依据,只适用于水溶液体系,而在非水溶液的条件下不一定适用,在高温下能发生反应:Na2CO3+SiO2 Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于H2SO4的强酸性,而是由于H2SO4为高沸点酸,HCl、HNO3为低沸点酸。
硅的用途:
高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池。硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备。
二氧化硅:
①化学式SiO2
②相对分子质量:60
③类别:酸性氧化物
④晶体类型:原子晶体
⑥晶体中粒子间的作用力:共价键
二氧化硅的物理性质和化学性质:
(1)物理性质:无色透明或白色粉末,原子晶体,熔沸点都很高,坚硬难熔,不溶于水,天然的二氧化硅俗称硅石,是构成岩石的成分之一。
(2)化学性质:不活泼
①不与水反应,不能跟酸(氢氟酸除外)发生反应。
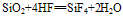 (氢氟酸不能盛放在玻璃容器中)。
(氢氟酸不能盛放在玻璃容器中)。②具有酸性氧化物的性质,能跟碱性氧化物或强碱反应。
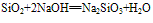 (实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
(实验室中盛放碱液的试剂瓶用橡胶塞而不用玻璃塞的原因)
 (制玻璃)
(制玻璃)③具有弱氧化性


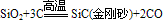
知识点拨:
二氧化硅晶体的结构若在硅晶体结构中的每个Si—Si键中“插入”一个氧原子,便可得到以硅氧四面体 (SiO4)为骨架的二氧化硅的结构,如图所示。在二氧化硅晶体里,硅原子和氧原子交替排列,不会出现Si—Si键和O—O键,即每个硅原子与四个氧原子形成四个共价键,每个氧原子与两个硅原子形成共价键,因此,二氧化硅晶体中硅原子和氧原子的个数比为1:2,二氧化硅的化学式为SiO2.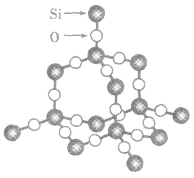
二氧化硅的用途:
①光导纤维的主要原料
②石英的主要成分是SiO2,纯净的石英可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 水晶常用来制造电子工业中的重要部件、光学仪器,也用来制造高级工艺品和眼镜片。
③玛瑙石含有有色杂质的石英晶体,可用于制造精密仪器轴承,耐磨器皿和装饰品。
合成有机高分子化合物:
由千百个原子彼此以共价键结合形成相对分子质量特别大、具有重复结构单元的有机化合物。是由一类相对分子质量很高的分子聚集而成的化合物,也称为高分子、大分子等。一般把相对分子质量高于10000的分子称为高分子。包括天然和合成有机高分子化合物。常见合成有机高分子化合物:聚乙烯、聚氯乙烯等
有机高分子化合物的合成:
高分子化合物大部分是由小分子通过聚合反应制得的。
(1)加聚反应:不饱和单体通过加聚反应生成高分子化合物。
①聚乙烯类(塑料、纤维)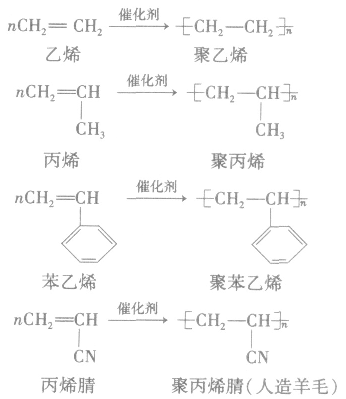
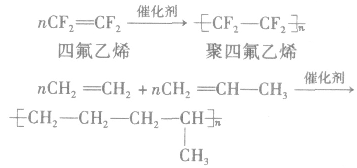
②聚二烯类(橡胶)
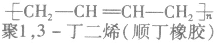
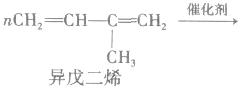
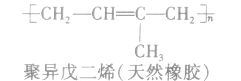
(2)缩聚反应:单体聚合成高分子的同时有小分子生成的聚合反应。
①聚酯类 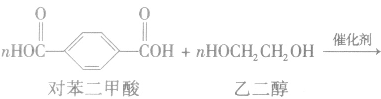
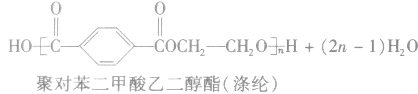
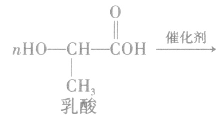
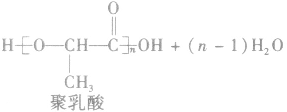
②聚氨基酯类
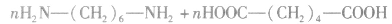
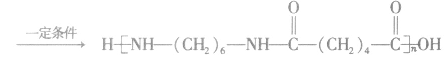
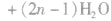

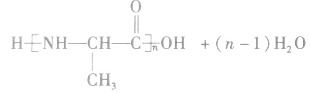
③酚醛树脂类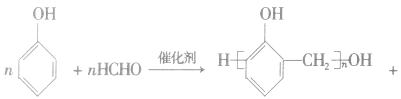
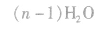
对高分子化合物的理解:
(1)通常把生成高分子化合物的低分子化合物(反应物)叫做单体(如乙烯是聚乙烯的单体),高分子化合物中化学组成相同、可重复的最小单位叫做链节(如一CH2一CH2一是聚乙烯的链节),高分子链中含有链节的数目叫做聚合度,通常用n表示。注意单体与链节是不同的,单体是反应前的低分子化合物;链节不是物质,不能独立存在,是反应后有机高分子化合物中的片段。 (2)低分子有机物的相对分子质量都有一个确定的数值,而高分子化合物的相对分子质量只是一个平均值。它是以低分子有机物作原料,经聚合反应得到各种相对分子质量不等的物质的混合物。
单体与高分子化合物的互推规律:
聚合时找准结合点,反推单体时找准分离处,“结合点必为分离处”。
1.由单体推断高聚物的方法
(1)单烯烃型单体加聚时,“断开双键,键分两端,添上括号,n写后面”。如

(2)二烯烃型单体加聚时,“单变双,双变单,破两头,移中间,添上括号.n写后面”。如
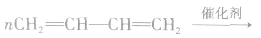
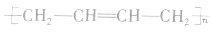
(3)分别含有一个双键的两种单体聚合时,“双键打开,中间相连,添上括号,n写后面”。如 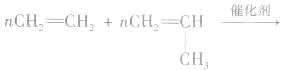
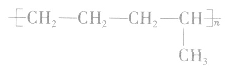
2.由高聚物推导单体的方法
(1)加聚产物单体的判断方法
①凡链节主链只有两个碳原子(无其他原子)的聚合物,其合成单体必为一种,将两个半键闭合即可。如
②凡链节主链有四个碳原子(无其他原子),且链节无双键的聚合物,其单体必为两种,在中央画线断开,然后两键闭合即可。如
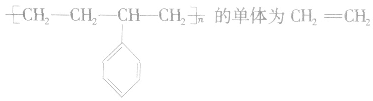
③凡链节主链上只有碳原子,斤存在碳碳双键结构的高聚物,其规律是“凡双键,四个碳;无双键,两个碳”画线断开。如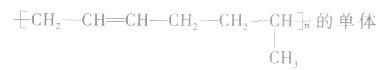
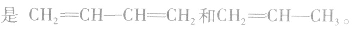
(2)缩聚产物单体的判断方法
①酯类高聚物中含有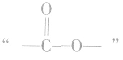 ,它的单体有两种,从
,它的单体有两种,从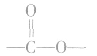 中间断开,
中间断开,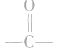 恢复为
恢复为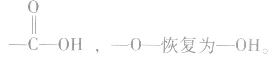
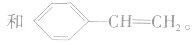
如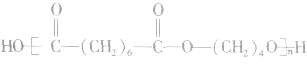 的单体为
的单体为
②酰胺类高聚物中含有"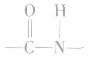 ",它的单体有两种,在亚氨基氮原子上加氢,羰基碳原子上加羟基,即得高聚物的单体。如
",它的单体有两种,在亚氨基氮原子上加氢,羰基碳原子上加羟基,即得高聚物的单体。如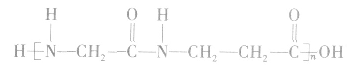 的单体为
的单体为
结构为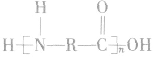 的高聚物,其合成单体必为一种,在亚氨基氮原子上加氢,在羰基碳原子上加羟基即得高聚物的单体。 如
的高聚物,其合成单体必为一种,在亚氨基氮原子上加氢,在羰基碳原子上加羟基即得高聚物的单体。 如 的单体为
的单体为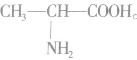
③酚醛树脂是由苯酚和甲醛缩聚而成的,链节中有酚羟基的结构。
如 和
和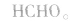
①煤的汽化:
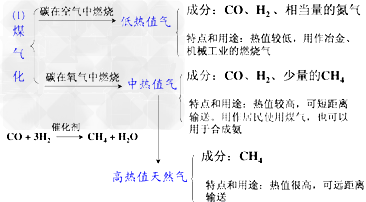
②煤的干馏:把煤隔绝空气加强热使它分解的过程,叫做煤的干馏

③煤的液化:煤的液化分直接液化和间接液化两种。

与“下列说法正确的是( )A.硅肺病又称矽肺病,它是一种职业病...”考查相似的试题有:
- 下列说法正确的是[ ]A.工业上用碳还原氧化铝生产铝B.氯水能使红色花瓣褪色C.常温下,硅与浓硝酸反应放出NO2D.铁制品比铝...
- 下列有关物质的性质或应用的说法不正确的是( )A.二氧化硅是生产光纤制品的基本原料B.水玻璃可用于生产黏合剂和防火剂C....
- 下列各组物质中,满足如下图物质一步转化关系的选项是[ ]X YZA.Na NaOHNaHCO3B.CuCuSO4Cu(OH)2C.C COCO2D.Si SiO2H2SiO3
- 下列有关物质用途的说法中,不正确的是A.硅可用作绝缘材料B.氯气可用于制取漂白粉C.二氧化硅可用于制造光导纤维D.氢氧化...
- A、B、C、D、E、F、G、H、I、J都是中学化学中的常见物质,各物质之间的转化关系如下图所示已知:①图中所有物质均由短周期元素...
- 下列说法不正确的是( )A.相同温度下,Na2CO3的溶解度小于NaHCO3B.晶体硅是制造半导体的主要原料C.液氯罐泄漏时,用浸有...
- 下图所示为物质A~K之间的转化关系,反应①为电解A的饱和溶液,是一种重要的化工反应,反应②③在工业上对某种物质的提纯具有非...
- 如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战.下列关于化石燃料以及使用的一些说...
- 下列有关叙述中错误的是[ ]A.纤维素分子是由葡萄糖单元构成的,可以表现出一些多元醇的性质B.蔗糖和淀粉的水解产物不同C....
- 下列说法错误的是A.催化裂化可以提高从石油得到的汽油等轻质油的产量B.石油分馏主要是化学变化C.裂化比裂解所需温度更高D...