本试题 “(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。(1)若有1mol CH4生成,则有 mol σ键和 mol π键断裂。(2)CH4失去H—(氢负...” 主要考查您对化学键与化学反应中能量变化的关系
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学键与化学反应中能量变化的关系
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。
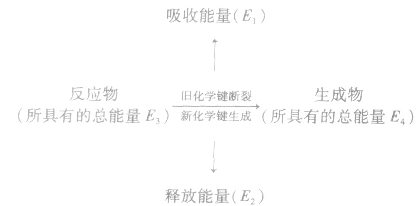
若 反应为放热反应;若
反应为放热反应;若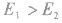 或
或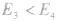 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若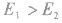 或
或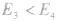 ,反应为吸热反应。
,反应为吸热反应。 发现相似题
与“(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2...”考查相似的试题有:
- 下列物质中,只含有非极性共价键的是( )A.Na2OB.H2OC.Cl2D.NH3
- 从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是A...
- 下列各式能真实表示物质分子组成的是( )A.CaF2B.CCl4C.SiO2D.Na2O2
- 只有化合物中才存在的化学键是A.极性键B.非极性键C.共价键D.氢键
- 将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1...
- 下列四种物质中,①硫化钾、②干冰、③氩、④氢氧化钠 存在共价键的分子晶体是______,只存在离子键的是______,既存在离子键又存...
- 下列反应中,生成物的总能量大于反应物总能量的是( )A.氢气在氧气中燃烧B.铁丝在氧气中燃烧C.硫在氧气中燃烧D.焦炭在高...
- 下列对分子结构叙述不正确的是( )A.H2O2分子中,两个O之间形成1对共用电子对B.N2的电子式是N┇┇NC.CCl4和甲烷都是正四面...
- 用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )A.直线形;三角锥型B.V形;三角锥型C.直线形;平面三...
- 氧是地壳中含量最多的元素。(1)氧元素基态原子核外未成对电子数为 个.(2)H2O分子内的O-H键、分子间的范德华力和氢键从强...