本试题 “下列说法正确的是[ ]A.用剩下的药品要放入原试剂瓶中B.加热试管中的液体时,试管口不要朝着有人的地方C.只含有一种元素的物质一定是一种单质D.氧化物一定是含...” 主要考查您对药品的取用
物质的加热
单质和化合物
氧化物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 药品的取用
- 物质的加热
- 单质和化合物
- 氧化物
①使用药品时的“三不(不触、不闻、不尝昧)”源则:不能用手接触约品,不要把鼻孔凑到容器口去闻药品(特别是气体)的气味,不得尝任何药品的味道
②取用药品时注意节约原则:取用药品应严格按照实验规定的用量取用。如果没有说明用量,一般按最少量(1~2mL)取用液体,固体只需盖满试管底部即可。最大量,液体不超过容器容积的1/3,固体不超过1/2。
③用剩药品的处理原则:实验用剩的药品不能因为要 “节约”而放回原试剂瓶,这样做会污染试剂瓶中未使用的药品。因此,用剩的药品既不能放回原试剂瓶,也不能随意丢弃,更不能带出实验室,要放在指定的容器中。
药品取用对比分析:
1、同体药品的取用
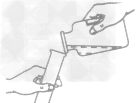
①取用粉末、颗粒状药品应使用药匙或纸槽,步骤:“一横、二送、三直立”,即将试管横放,用药匙或纸槽将药品送人试管底部(如下图所示),再把试管直立起来,让药品滑入试管底部。

②取用块状药品或较大的金属颗粒时应用镊子夹取,步骤:“一横、二放、三慢竖”,即先将试管(或容器) 横放,把药品放人试管(或容器)口以后(如下图所示),再把试管(或容器)慢慢竖立起来,使块状固体缓慢地滑到试管底部,防止打破试管(或容器)底。

2、液体药品的取用
①滴管吸取法:取少量液体时,可用胶头滴管吸取 (如下图所示)。
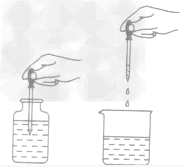
②取用较多量时,可用倾倒法。步骤:先拿下瓶塞,倒放在桌上;然后拿起试剂瓶,标签朝向手心,瓶口要紧挨着试管口,使液体缓缓倒入试管(如下图)。
3、定量取用药品
①物质的称量。使用托盘天平称量药品时:使用天平先调零,左物右码要分清,玻璃器皿、称量纸,镊子夹码手不行。即称前先将天平调平衡,称量物放在左盘,砝码放在右盘。托盘上要垫有大小一样的称量纸,如果是腐蚀性药品,要放在表面皿或蒸发皿中称量。用镊子夹取砝码,直到平衡。托盘天平只能准确到0.1克。
②液体的量取。根据被量液体的体积选择合适规格的量筒。“使用量筒先放平,量简刻度没有零,视线与凹液最低点,保持一致方可行”。
注意事项:
1、不能用手接触药品、不能直接闻气体、不能尝药品的味道。
2、块状固体:用镊子夹持,将试管平放,用镊子将块状固体放入试管中,然后慢慢将试管竖起,
使块状固体慢慢滑入试管底部,防止打破试管底
3、粉末状固体:将试管倾斜,把盛有药品的药匙或纸槽送入试管底部,然后将试管直立起来,
让药品落入底部
4、液体药品:取下瓶塞倒放在桌面上,标签握在手心里,口口相挨免外流,试管略倾便操作。
使用胶头滴管时,要两两对正,滴管竖直悬空,不能伸入其中,更不能相碰。吸液后胶头滴管不可倒置或平放,防止药液腐蚀橡胶帽。若用滴管取完液体后,可用少量清水冲洗,以备再用。滴瓶上的滴管,不可交叉使用,也不可用清水冲洗。
节约原则:
没有说明药品用量时,液体药品一般取用1—2mL,固体药品一般以盖满试管底部为原则。
防污染原则:
取用后多余的药品不能放回试剂瓶;胶头滴管滴加药品时,不能倒置,也不能将胶头滴
管的尖嘴伸入仪器口内。用过的药匙、镊子应该用滤纸等擦干净以备用。粉末药品应用纸条取用。
物质加热的方法:
1、加热时,受热容器外壁不能含水,以防止受热不均而破裂。
2、操作时,先要来回移动使试管均匀受热(预热),以防局部受热而使试管破裂。
3、对盛有液体的试管加热,要使管口向斜上方倾斜(约45°角),不得将试管口对人,以防液体喷出试管口而伤人。
4、加热时,还要不断振荡试管,以防止局部受热沸腾而飞溅。
液体物质的加热:
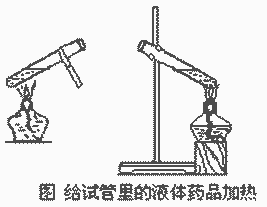
1、液体体积不超过试管容积的1/3;
2、试管外壁必须擦干;
3、加热前要预热,用外焰加热;
4、试管与桌面成45。,管口不得对人。
固体物质的加热:
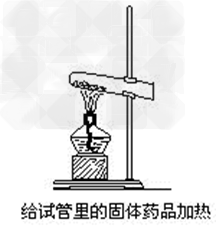
1、加热前需先将试管外壁擦干;
2、试管口要稍向下倾斜;
3、要先均匀预热,再集中在盛固体部位加热;
4、加热过程中,不要让试管跟灯芯接触,以免试
管炸裂。
问答点拨:
1、加热试管里的液体时,能否将试管口对着人?
答:不能。不得将试管对着人,以防液体喷出试管口而伤人。
2、如果试管外壁有水的话,能否直接加热?
答:不能。加热时,试管外壁不能有水,以防止试管受热不均而破裂。
3、液体沸腾时的试管,能否立即用冷水冲洗?
答:不能。热试管骤冷会破裂。
4、如何给试管中的液体进行预热?
答:手持试管夹在酒精灯火焰外焰处来回移动试管,如果试管固定可以左右移动酒精灯。
水浴加热:
(1)什么是水浴加热把要加热的物质放在水中,通过给水加热达到给物质加热的效果。一般都是把要反应的物质放在试管中,再把试管放在装有水的烧杯里,再在烧杯中插一根温度计,控制反应的温度。
(2)水浴加热的优点水浴加热可以避免直接加热造成的过度剧烈和温度的不可控制性,可以平稳均匀的加热,许多反应需要严格控制温度,就需要水浴加热。
使用酒精灯时,要注意以下几点:
(1)酒精灯内的酒精不超过容积的2/3,不得少于容积的1/4 ;
(2)点燃酒精灯时先用镊子调节灯芯高低、 平整,再点燃;
(3)绝对禁止向燃着的酒精灯内添加酒精;
(4)绝对禁止用燃着的酒精灯引燃另一盏酒精灯,以免引起火灾;
(5)用完酒精灯后必须用灯帽盖灭,不可用嘴去吹灭;
(6)不要碰倒酒精灯,万一洒出的酒精在桌面燃烧,应立刻用湿抹布扑灭 。
常见仪器的耐热性:
试管、坩埚、蒸发皿,直接加热不用问。烧杯、烧瓶、锥形瓶,石棉网下酒精灯。量筒、水槽、集气瓶,不可受热记在心。
给物质加热的注意事项:
给物质加热时,若被加热的玻璃容器外壁有水,应擦干再加热,以免容器炸裂;加热时玻璃容器底部不能跟灯芯接触,也不能离得太远;烧得很热的玻璃容器,不要立即用冷水冲洗(以免容器炸裂),也不要直接放在实验台上 (防止烫坏实验台),要垫上石棉网。
(1)概念:由同种元素组成的纯净物。
(2)单质的分类:依据组成单质元素的性质把一单质分为三类。
金属单质:由金属元素组成的单质,如铁、铜、银等
非金属单质:由非金属元素组成的单质,如碳、磷、氧气等
稀有气体单质:由稀有气体元素组成的单质,如氦、氖、氛等单质
化合物:
(1)概念:由不同种元素组成的纯净物。
(2)化合物的分类:化合物分为有机化合物和无机化合物。
单质和化合物的区别和联系:
| 单质 | 化合物 | ||
| 区别 | 宏观组成 | 同种元素 | 不同种元素 |
| 微观构成 | 有同种原子构成 | 由不同种原子构成 | |
| 化学性质 | 不能发生分解反应 | 一定条件下发生分解反应 | |
| 联系 | 相互转变 | 它们均属于纯净物。单质发生化合反应可以生成化合物,化合物发生分解反应可以生成单质 | |
| 质子数 | 同一种元素的原子,不论在一单质里还是在化合物里,原子核内质子数保持不变 | ||
化合物与氧化物的区别和联系:
| 化合物 | 氧化物 | |
| 区别 | ①由不同种元素组成的纯净物叫化合物 ②由两种或两种以上元素组成 ③不一定含有氧元素 ④属于纯净物中的一类 |
①由两种元素组成的化合物中,如果有一种元素是氧元素,这种化合物叫氧化物 ②一定由两种元素组成 ③一定含有氧元素 ④属于化合物中的一类 |
| 联系 | 氧化物和化合物是个体与总体的关系,氧化物属于化合物中的一类 | |
同种元素组成的物质一定是单质吗?
由同种元素组成的纯净物叫做单质。理解单质的概念必须抓住两点:①由同种元素组成;②必须是纯净物,如氧气是一单质。由同种元素组成的物质不一定是单质,也可能是混合物,但绝不可能是化合物,如氧气 (O2)、臭氧(O3)两种物质混在一起是一种混合物,但是只有一种氧元素;同样的例子还有红磷和白磷,金刚石和石墨等。
对单质和化合物概念的理解:
(1)单质的概念:
①理解一单质的概念不仅要关注它是由一种元素组成,还应注意它首先是一种纯净物。如:氧气、氮气、碳、硫、铁、铜、各种稀有气体等都属于单质。
②由同种元素组成的物质不一定是单质,还可能是混合物:如:氧气与臭氧的混合物、白磷与红磷的混合物、金刚石与石墨的混合物等都只含一种元素,但都属于混合物。
(2)化合物的概念:理解化合物的概念同样不仅要关注它是由两种或两种以上的元素组成,还应注意它首先是一种纯净物。如二氧化碳,氯化钠、高锰酸钾等都属于化合物。
共价化合物与离子化合物的区别:
1. 共价化合物
(1)概念:像HCl、CO2这样以共用电子对结合在一起的化合物为共价化合物。
(2)共价化合物的类型:
①两种非金属原子结合成的化合物,如HCl、CO2等。
②非金属与酸根构成的化合物,如H2SO4、HNO3等。
2. 离子化合物与共价化合物的区别:
离子化合物是由阴、阳离子相互作用形成的化合物;共价化合物是原子间全部以共用电子对结合形成的化合物。离子化合物由离子构成,共价化合物大多数由分子构成。
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
与“下列说法正确的是[ ]A.用剩下的药品要放入原试剂瓶中B.加热试...”考查相似的试题有:
- 液体药品经常盛放在______里,取用时,瓶塞应______在实验台上,试剂瓶口与试管口应______.若实际没有说明用量,液体应取___...
- 实验过程中要注意安全,下列实验操作安全的是( )A.用药匙或镊子取用药品B.将鼻孔凑到容器口去闻药品的气味C.给试管内液...
- 鞍山玉佛驰名中外,它的主要成份是富镁硅酸盐[化学式为Mg6Si4O10(OH)8)。下列有关说法正确的是A.鞍山玉佛是一种纯净物 B....
- 下列物质中,属于纯净物的是A.冰镇啤酒B.新鲜空气C.优质燃煤D.高锰酸钾
- 下列叙述正确的是( )A.纯碱、烧碱都属于碱B.有单质生成的反应一定是分解反应C.化学反应中一定有能量变化D.由两种元素组...
- 现有如下物质①液氧;②洁净的空气;③高锰酸钾;④冰水混合物;⑤水银;⑥过氧化氢.请用序号填空:(1)由原子构成的物质是______...
- “可燃冰”是其中海底蕴藏的资源之一,其主要成分是甲烷。甲烷在空气中燃烧的微观过程模拟图如下:(1)结合该图示从微观角度解...
- 氢元素有3种不同的原子,其原子核内的中子数依次为0、1、2。这3种原子与金属锂形成的氢化锂 “三兄弟”——LiH、LiD、LiT是 “神舟...
- 下列各组物质,按混合物、化合物、单质顺序排列的是( )A.冰水共存物、二氧化硫、氮气B.石油、煤、天然气C.洁净的空气、...
- 自来水进入输水管道之前要进行消毒处理.自来水消毒过程中所发生化学反应的微观过程可用下图表示:图中的氧化物的化学式为___...