本试题 “我们学过有六种途径可以制得氧气,如下所示:(1)写出B、C两种途径的反应的文字表达式:B: .C: .(2) (填字母代号)途径发生的是物理变化.(3)在发...” 主要考查您对绿色化学
氧气的制取和收集
催化剂和催化作用
分解反应
文字表达式
物理变化和化学变化的特征和判别
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 绿色化学
- 氧气的制取和收集
- 催化剂和催化作用
- 分解反应
- 文字表达式
- 物理变化和化学变化的特征和判别
绿色化学又称“环境无害化学”、“环境友好化学”、“清洁化学”,绿色化学是近十年才产生和发展起来的,是一个“新化学婴儿”。它涉及有机合成、催化、生物化学、分析化学等学科,内容广泛。绿色化学的最大特点是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染。世界上很多国家已把“化学的绿色化”作为新世纪化学进展的主要方向之一。
绿色化学性质:
(1)充分利用资源和能源,采用无毒、无害的原料;
(2)在无毒、无害的条件下进行反应,以减少向环境排放废物;
(3)提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;
(4)生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
“绿色”不是指颜色为绿色,而是指无污染。
绿色化学核心:
利用化学原理从源头上减少和消除工业生产对环境的污染。 绿色化学国际杂志(greenchemistry) 绿色化学国际杂志(greenchemistry) 按照绿色化学的原则、最理想的化工生产方式是:反应物的原子全部转化为期望的最终产物。
绿色化学途径:
(1)开发绿色实验。如实验室用H2O2分解制O2代替KClO3分解法,实现了原料和反应过程的绿色化。
(2)防止实验过程中尾气、废物等环境的污染,实验中有危害性气体产生时要加强尾气吸收,对实验产物尽可能再利用等。
(3)在保证实验效果的前提下,尽量减少实验试剂的用量,使实验小型化、微型化。
(4)对于危险或反映条件苛刻,污染严重或仪器、试剂价格昂贵的实验,可采用计算机模拟化学实验或观看实验录像等办法。
(5)妥善处置实验产生的废物,防止环境污染。
绿色化学性质:
(1)充分利用资源和能源,采用无毒、无害的原料;
(2)在无毒、无害的条件下进行反应,以减少向环境排放废物;
(3)提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;
(4)生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
“绿色”不是指颜色为绿色,而是指无污染。
绿色化学核心:
利用化学原理从源头上减少和消除工业生产对环境的污染。 绿色化学国际杂志(greenchemistry) 绿色化学国际杂志(greenchemistry) 按照绿色化学的原则、最理想的化工生产方式是:反应物的原子全部转化为期望的最终产物。
绿色化学途径:
(1)开发绿色实验。如实验室用H2O2分解制O2代替KClO3分解法,实现了原料和反应过程的绿色化。
(2)防止实验过程中尾气、废物等环境的污染,实验中有危害性气体产生时要加强尾气吸收,对实验产物尽可能再利用等。
(3)在保证实验效果的前提下,尽量减少实验试剂的用量,使实验小型化、微型化。
(4)对于危险或反映条件苛刻,污染严重或仪器、试剂价格昂贵的实验,可采用计算机模拟化学实验或观看实验录像等办法。
(5)妥善处置实验产生的废物,防止环境污染。
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型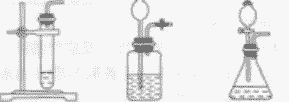 |
固体加热型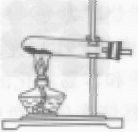 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 | 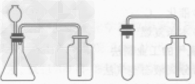 |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
催化剂及催化作用的概念:
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
| 概念 | |
| 催化剂 | 在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。 |
| 催化作用 | 催化剂在化学反应中所起的作用 |
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
概念:
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O 2H2↑+O2↑
2H2↑+O2↑
2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3 CaO+CO2↑
CaO+CO2↑
⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3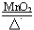 2KCl+3O2↑
2KCl+3O2↑
⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4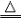 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;
2H3PO4 H4P2O7+H2O↑
H4P2O7+H2O↑
3H3PO4 H5P3O10+2H2O↑
H5P3O10+2H2O↑
2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑
K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
由一种物质生成两种或两种以上物质的反应
特征:
一变多
表达式:
A = B + C
初中常见的分解反应:
按产物种类多少分类:
一、加热分解的产物有两种
1.分解成两种单质
⑴气态氢化物的分解
碘化氢的分解2HI=H2↑+I2
⑵氯化银的分解
氯化银的分解2AgCl=2Ag+Cl2↑
⑶电解
电解水2H2O
 2H2↑+O2↑
2H2↑+O2↑2.分解成两种化合物
⑴不稳定盐类的分解
碳酸钙的高温分解CaCO3
 CaO+CO2↑
CaO+CO2↑ ⑵不稳定弱碱的分解
氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
⑶不稳定弱酸的分解
碳酸的分解H2CO3=H2O+CO2↑
⑷含结晶水的盐类的脱水
十水碳酸钠的风化Na2CO3·10H2O=Na2CO3+10H2O
3.分解成一种单质和一种化合物
⑴不太稳定的盐类的分解
氯酸钾的催化分解2KClO3
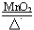 2KCl+3O2↑
2KCl+3O2↑⑵不稳定酸的分解
次氯酸的分解2HClO=2HCl+O2
⑶双氧水的分解
受热(或以二氧化锰为催化剂)分解2H2O2=2H2O+O2
4.有机物的分解
甲烷的裂解2CH4=C2H2+3H2
二、加热分解的产物有三种
1.不稳定盐类的分解
⑴碳酸氢钠受热分解2NaHCO3=Na2CO3+CO2↑+H2O
⑵亚硫酸的酸式强碱盐受热分解
亚硫酸氢钠受热分解 2NaHSO3=Na2SO4+SO2↑+H2O
⑶铵盐的受热分解
碳酸铵受热分解
(NH4)2CO3=2NH3↑+H2O↑+CO2↑
⑷高锰酸钾受热分解
2KMnO4
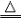 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ ⑸硝酸盐的受热分解
硝酸银的受热分解2AgNO3=2Ag+2NO2↑+O2↑
2.硝酸的分解
4HNO3=4NO2+O2+2H2O
3.电解水溶液
⑴电解饱和食盐水
2NaCl+2H2O=2NaOH+H2↑+Cl2↑
按反应物种类进行分类:
1.酸的分解反应。
⑴含氧酸=非金属氧化物+水 如H2CO3=CO2↑+H2O,H2SO3=SO2↑+H2O
⑵某些含氧酸的分解比较特殊, 如
硝酸的分解: 4HNO3(浓)=4NO2↑+O2↑+2H2O,
次氯酸分解 2HClO=2HCl+O2↑
磷酸脱水 4H3PO4
 (HPO3)4+4H2O↑ ;
(HPO3)4+4H2O↑ ;2H3PO4
 H4P2O7+H2O↑
H4P2O7+H2O↑ 3H3PO4
 H5P3O10+2H2O↑
H5P3O10+2H2O↑ 2.碱的分解反应:
活泼金属的氢氧化物较难分解,难溶性碱一般都较易分解: 2Al(OH)3=Al2O3+3H2O, 2Fe(OH)3=Fe2O3+3H2O, Cu(OH)2=CuO十H2O。
3.盐的分解反应:
碳酸盐、硝酸盐、铵盐一般都较易分解,且反应表现出一定的规律性。
⑴碳酸盐的分解:
碳酸盐=金属氧化物十CO2↑ 如CaCO3
 CaO+CO2↑,CuCO3
CaO+CO2↑,CuCO3 CuO+CO2↑
CuO+CO2↑K2CO3、Na2CO3比较稳定,很难分解,而其酸式盐较易分解:
2NaHCO3=Na2CO3+CO2↑+H2O
Ca(HCO3)2=CaCO3+CO2↑+H2O
⑵硝酸盐的分解反应。硝酸盐受热均易分解,并放出氧气,其规律大体如下:
活动性强的金属(K、Ca、Na)硝酸盐=亚硝酸盐+O2↑:
如 2KNO3=2KNO2+O2↑。
处于活动性顺序表中间的金属(Mg、Cu等)的硝酸盐=金属氧化物+NO2↑+O2↑:
如2Mg(NO3)2=2MgO+4NO2↑+O2↑ 2Cu(NO3)2=2CuO+4NO2↑+O2↑
不活动金属(Hg、Ag、Au)的硝酸盐=金属+NO2↑+O2↑:
如 Hg(NO3)2=Hg+2NO2↑+O2↑; 2AgNO3=2Ag+2NO2↑+O2↑
⑶铵盐的分解反应。铵盐受热易分解,一般都有氨气放出:
如(NH4)2SO4=2NH3↑+H2SO4 ;NH4HCO3=NH3↑+CO2↑+H2O。
⑷其它盐类的分解反应
如 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑
4.氧化物的分解反应:
非金属氧化物一般不容易发生分解反应 2H2O2=H2↑+O2↑
金属氧化物一般分解的规律是: 金属活动顺序表中,排在铜后的金属氧化物受热易分解:
如 2HgO=2Hg+O2↑,2Ag2O=4Ag+O2↑
活泼的金属氧化物,给它们熔化态通电流可使其分解:
如2Al2O3(熔化)=4Al+3O2↑
概念:用文字表示化学反应的式子
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
文字表达式的书写步骤:
(1)写:根据反应事实写出反应物和生成物
(2)注:注明反应条件:[点燃,加热,光照,通电等]
物理变化:
1. 定义:没有生成其他物质的变化
2. 实例:灯泡发光,冰融化成水;水蒸发变成水蒸气;碘,干冰的升华,汽油挥发,蜡烛熔化等都是物理变化。
化学变化:
1. 定义:物质发生变化时生成其他物质的变化。
2. 实例:木条燃烧,铁生锈,食物腐烂
3. 现象:化学变化在生成新物质的同时,时常伴随着一些反应现象,表现为颜色改变,放出气体,生成沉淀等,化学变化不但生成其他物质,而且哈伴随着能量的变化,这种能量变化常表现为吸热,放热,发光等。
物理变化概念的理解:
(1)扩散,聚集,膨胀,压缩,挥发,摩擦生热,升温,活性炭吸附氯气等都是物理变化
(2)石墨在一定条件下变成金刚石不是物理变化而是化学变化,因为变成了另一种物质
(3)物理变化前后,物质的种类不变,组成不变,化学性质不变
(4)物理变化的实质是分子的聚集状态发生了改变,导致物质的外形或状态随之改变。
成语、俗语、古诗词蕴含的化学知识
(1)成语、俗语中的变化
①物理变化:只要功夫深,铁柞磨成针;
冰冻三尺非一日之寒;
木已成舟;滴水成冰;花香四溢等。
②化学变化:百炼成钢、点石成金、蜡炬成灰等。
(2)古诗词中的变化于谦的《石灰吟》:
千锤万凿出深山—物理变化
烈火焚烧若等闲—化学变化
粉身碎骨浑不怕—化学变化
要留清白在人间—化学变化
物质的三态变化
(1)物态变化是指同一种物质可在固态,气态,液态三种状态发生转化的过程,如下图,物态变化过程没有新物质生成,属于物理变化。

(2)物态变化过程中的名称和热量变化
1. 定义:没有生成其他物质的变化
2. 实例:灯泡发光,冰融化成水;水蒸发变成水蒸气;碘,干冰的升华,汽油挥发,蜡烛熔化等都是物理变化。
化学变化:
1. 定义:物质发生变化时生成其他物质的变化。
2. 实例:木条燃烧,铁生锈,食物腐烂
3. 现象:化学变化在生成新物质的同时,时常伴随着一些反应现象,表现为颜色改变,放出气体,生成沉淀等,化学变化不但生成其他物质,而且哈伴随着能量的变化,这种能量变化常表现为吸热,放热,发光等。
物理变化:
1. 特征:没有新物质生成。
2. 微观实质:分子本身没有变(对于由分子构成的物质),主要指形状改变或三态变化。
化学变化:
1. 特征:有新物质生成
2. 微观实质:物质发生化学变化时,反应物的分子在化学反应中分成了原子,原子重新组成构成新分子。
物理变化概念的理解:
(1)扩散,聚集,膨胀,压缩,挥发,摩擦生热,升温,活性炭吸附氯气等都是物理变化
(2)石墨在一定条件下变成金刚石不是物理变化而是化学变化,因为变成了另一种物质
(3)物理变化前后,物质的种类不变,组成不变,化学性质不变
(4)物理变化的实质是分子的聚集状态发生了改变,导致物质的外形或状态随之改变。
成语、俗语、古诗词蕴含的化学知识
(1)成语、俗语中的变化
①物理变化:只要功夫深,铁柞磨成针;
冰冻三尺非一日之寒;
木已成舟;滴水成冰;花香四溢等。
②化学变化:百炼成钢、点石成金、蜡炬成灰等。
(2)古诗词中的变化于谦的《石灰吟》:
千锤万凿出深山—物理变化
烈火焚烧若等闲—化学变化
粉身碎骨浑不怕—化学变化
要留清白在人间—化学变化
物质的三态变化
(1)物态变化是指同一种物质可在固态,气态,液态三种状态发生转化的过程,如下图,物态变化过程没有新物质生成,属于物理变化。

(2)物态变化过程中的名称和热量变化
| 变化过程 | 名称 | 热量变化 |
| 固态→气态 | 升华 | 吸热 |
| 气态→固态 | 凝华 | 放热 |
| 固态→液态 | 熔化 | 吸热 |
| 液态→固态 | 凝固 | 放热 |
| 液态→气态 | 汽化 | 吸热 |
| 气态→液态 | 液化 | 放热 |
发现相似题
与“我们学过有六种途径可以制得氧气,如下所示:(1)写出B、C两...”考查相似的试题有:
- 医务人员用3%的过氧化氢溶液为伤者处理伤口时,伤口上会看到冒气泡。下列有关说法中,不正确的是A.生成的气体可能是过氧化氢...
- (11分)某校研究性学习小组到实验室进行探究实验。他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质。(1)写出用该方...
- 下列有关氧气性质的描述中,错误的是A.氧气不易溶于水B.相同条件下,氧气的密度比空气大C.液态氧无色、无味D.氧气能助燃
- 下列关于氧气、水和二氧化碳的说法中,正确的是A.氧气的化学性质比较活泼,常用作燃料B.天然硬水经静置、过滤、吸附后将变...
- 铅(Pb)是一种化学性质比较活泼的金属,纯净的铅外观和铁相似.相同体积的铅和铁比较,铅比铁重,把纯铅放置在空气中.过一...
- 正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次).小资料:通常状况下,CO是一种无...
- (1)现有H+、OH-、NO3-、Fe3+四种离子,请写出它们可能组成的酸、碱、盐的化学式:酸______;碱______;盐______.(2)根据...
- 下列过程中发生了化学变化的是A 用金刚石切割玻璃 B 用铅笔在纸上写字C 用醋酸清洗热水瓶的水垢 D 用水将浓盐酸稀释
- 物质的性质决定用途,下列物质的用途和性质不一致的是A.铜导电性好——作导线B.铝密度小——作飞机材料C.金延展性好——做成金箔...
- 下列关于水的描述中属于化学性质的是( )A.密度是1.0 g/cm3B.熔点是0℃C.沸点是100℃D.通电分解生成氢气和氧气