本试题 “下列叙述正确的是( )A.氧化物是指含有氧元素的化合物B.MnO2是化学反应中的催化剂C.酸和碱中一定都含有氢、氧两种元素D.化合反应的生成物一定只有一种物质” 主要考查您对催化剂和催化作用
化合反应
酸、碱、盐
氧化物
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 催化剂和催化作用
- 化合反应
- 酸、碱、盐
- 氧化物
- 元素的定义
催化剂及催化作用的概念:
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
| 概念 | |
| 催化剂 | 在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。 |
| 催化作用 | 催化剂在化学反应中所起的作用 |
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
概念:指的是由两种或两种以上的物质生成一种新物质的反应。其中部分反应为氧化还原反应,部分为非氧化还原反应。 此外,化合反应一般释放出能量。
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2 CO2
CO2
3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2 2NaCl
2NaCl
4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2 2H2O
2H2O
5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2 SO2
SO2
10.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4
注意:不是所有的化合反应都是放热反应。
特征:多变一
表达式:a+b=ab
初中常见化合反应:
1.金属+氧气→金属氧化物
很多金属都能跟氧气直接化合。例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。4Al+3O2=2Al2O3
2.非金属+氧气→非金属氧化物 经点燃,许多非金属都能在氧气里燃烧,如:C+O2
 CO2
CO2 3.金属+非金属→无氧酸盐 许多金属能与非金属氯、硫等直接化合成无氧酸盐。如 2Na+Cl2
 2NaCl
2NaCl 4.氢气+非金属→气态氢化物 因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。如 2H2+O2
 2H2O
2H2O 5.碱性氧化物+水→碱. 多数碱性氧化物不能跟水直接化合。判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。如: Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。如: CO2+H2O=H2CO3
7.碱性氧化物+酸性氧化物→含氧酸盐 Na2O+CO2=Na2CO3。大多数碱性氧化物和酸性氧化物可以进行这一反应。其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵 氨气易与氯化氢化合成氯化铵。如: NH3+HCl=NH4Cl
9.硫和氧气在点燃的情况下形成二氧化硫 S+O2
 SO2
SO210.特殊化合反应
公式 A+B+…+N→X(有些化合反应属于燃烧反应)
例如:铁+氧气
 四氧化三铁 3Fe+2O2
四氧化三铁 3Fe+2O2 Fe3O4
Fe3O4酸:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
1. 定义:电离时生成的阳离子全部是H+的化合物
2. 常见的酸:HCl,H2SO4,HNO3,H3PO4。
碱:
1. 定义:电离时生成的阴离子全部是OH-的化合物
2. 常见的碱:NaOH,KOH,Cu(OH)2,Fe(OH)3等
盐:
1. 定义:电离时生成金属离子(包括NH4+)和酸根离子的化合物
2. 常见的盐:NaCO3,NaCl,NaSO4等
酸、碱、盐的比较:
| 从化学组成看 | 从电离观点看 | 组成特点 | |
| 酸 | 由氢元素和酸根组成 | 电离时生成的阳离子全都是氢离子(H+)的化合物 | 一定含氢元素 |
| 碱 | 由金属元素和氢氧根组成(氨水也是碱) | 电离时生成的阴离子全都是氢氧根离子(OH-)的化合物 | 一定含氢、氧 元素 |
| 盐 | 含有金属元素(或NH4+) 和酸根 | 电离时能生成金属离子(或NH4+)和酸根离子的化合物 | 酸式盐中一定含氢元素,碱式盐中一定含氢、氧元素 |
氧化物:
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
1.定义:由两种元素组成,其中一种是氧元素的化合物(即由氧元素和另一种元素组成的化合物)。
2.分类:
(1)根据组成分类:
金属氧化物,如Na2O,CuO等
非金属氧化物,如CO2,NO等
(2)根据性质分类:
①酸性氧化物
能和碱反应生成盐和水的氧化物如CO2,SO3等
②碱性氧化物
能和酸反应生成盐和水的氧化物如CaO、Fe2O3等
③两性氧化物(初中不作要求)
④不成盐氧化物
不能直接反应生成盐的氧化物如CO,NO等
金属氧化物性质小结:
1.与水反应生成碱(可溶性金属氧化物)
Na2O+H2O==2NaOH
CaO+H2O==Ca(OH)2
2.与强酸反应
CaO+2HCI==CaCl2+H2O
Fe2O3+6HCl==2FeCl3+3H2O
Fe2O3+3H2SO4==Fe2(SO)3+3H2O
CuO+2HCl==CuCl2+H2O
CuO+H2SO4==CuSO4+H2O
3.与H2、CO或C反应
CuO+H2==Cu+H2O
2CuO+C==2Cu+CO2↑
CuO+CO==Cu+CO2
Fe2O3+3H2==2Fe+3H2O
2Fe2O3+3C==4Fe+3CO2↑
Fe2O3+3CO==2Fe+3CO2
Fe3O4+4H2==3Fe+4H2O
Fe3O4+2C==3Fe+2CO2↑
Fe3O4+4CO==3Fe+4CO2
非金属氧化物性质小结:
1.部分非金属氧化物与水反应生成相应的酸
CO2+H2O==H2CO3
SO2+H2O==H2SO3
2.与碱反应生成盐和水
Ca(OH)2+CO2==CaCO3↓+H2O
2NaOH+CO2==Na2CO3+H2O
Ca(OH)2+SO2==CaSO3↓+H2O
2NaOH+SO2==Na2SO3+H2O
易错点:
①酸性氧化物多数是非金属氧化物,但也可能是金属氧化物(如Mn2O7);碱性氧化物肯定是金属氧化物。
②非金属氧化物一般都是酸性氧化物,但H2O、CO、NO等不是酸性氧化物。
过氧化物:
常见的过氧化物有过氧化氢(H2O2)、过氧化钠 (Na2O2)。
过氧化氢俗称双氧水,在催化剂的催化作用下能分解生成水和氧气,常用于实验室制取氧气。过氧化氢具有极强的氧化性,可用作杀菌剂,漂白剂。
过氧化钠能与二氧化碳反应:2Na2O2+2CO2== 2Na2CO3+O2,根据该性质,可将过氧化钠用在坑道、潜艇或宁宙飞船等缺氧的场所,将人们呼出的CO2转换成O2,供给呼吸。
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
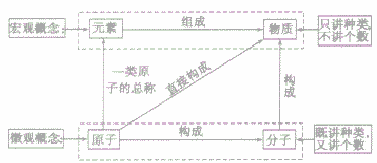
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
发现相似题
与“下列叙述正确的是( )A.氧化物是指含有氧元素的化合物B.Mn...”考查相似的试题有:
- 图表资料可以为我们提供很多信息。下列从图表中获取的信息不正确的是( )A.从元素周期表中查找原子序数B.根据金属活动性顺...
- 写出下列有关反应的文字表达式,并指出反应类型1. 铁在空气中燃烧_________________,基本反应类型为:__________2. 实验室用...
- 某校实验室将药品分类后放在不同的药品柜里,巳存放的部分药品如下:药品柜编号①②③④…药品氢氧化钠氢氧化钙盐酸硫酸二氧化锰氯...
- 给物质分类便于我们认识和学习。下列对各组物质的分类不正确的是[ ]A. 单质--石墨、氢气B. 氧化物--干冰、五氧化二磷C. 酸--...
- 下列说法中正确的是( )A.凡是能在水溶液中解离出H+的化合物就是酸B.氢氧化钾和氢氧化镁均能使无色酚酞试液呈红色C.浓盐...
- 下列物质中属于氧化物的是[ ]A.食盐B.空气C.白酒D.干冰
- 下列物质中,属于纯净物的是 ( )A.石灰水B.自来水C.金刚石D.空气
- 根据化学方程式不能获得的信息是A.该反应中的反应物和生成物B.化学反应的快慢C.反应发生所需要的条件D.参加反应的各粒子...
- 常州产的“仙鹤”牌酱油中有一种加铁酱油,这里指的“铁”是( )A.改善酱油的味道B.减少厨房的污染物C.预防缺铁性贫血D.是为...
- 玛丁啉是一种常见的胃药,可促进胃动力,消除胃胀胃痛等不适症状.已知玛丁啉的化学式为C22H24ClN5O2,请回答:(1)玛丁啉是...