本试题 “下列家庭小实验的设计方案中,不能达到预期实验目的的是[ ]A.用观察颜色的方法区别白糖和食盐B.用闻气味的方法区别饮用酒和食醋C.用洁厕精(含有盐酸)来...” 主要考查您对蜡烛燃烧
物质的除杂
物质的鉴别
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 蜡烛燃烧
- 物质的除杂
- 物质的鉴别
对蜡烛及其燃烧的探究的:对蜡烛在点燃前、点燃时和熄灭后的三个阶段进行细致的观察,学会完整地观察物质的变化过程及其现象。
蜡烛燃烧实验探究:
1. 实验活动:
| 实验探究步骤 | 观察物质的性质、变化及现象 | 结论解释及文字表达式 | |
| 观察蜡烛的制作材料 | 烛心棉线,外部石蜡 | 石蜡制成 | |
| 点燃前 | 观察蜡烛的颜色、状态、形状 | 乳白色,固态,圆柱状 | 乳白色,固态 |
| 用小刀切下一块石蜡,投入水中 | 很容易切开,浮在水面上,难溶于水 | 密度比水小,较软,难溶于水 | |
| 点燃蜡烛 | 用火柴点燃蜡烛,观察蜡烛火焰 | 火焰分为三层,外层最明亮,内层最暗 | 火焰分为三层,外层最明亮,内层最暗 |
| 将一根火柴迅速平放在火焰中,1s后取出 | 外层最先炭化,内层最后炭化(甚至不炭化) | 外层温度最高 内层温度最低 | |
| 用一干而冷的烧杯罩在火焰上,片刻取下烧杯,迅速向烧杯内倒入少量澄清石灰水,振荡 | 烧杯内壁有水雾,澄清石灰水变浑浊 | 蜡烛燃烧生成了水和二氧化碳:蜡烛+氧气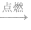 水+二氧化碳 水+二氧化碳 | |
| 熄灭蜡烛 | 将蜡烛熄灭,观察 | 有白烟 | 蜡烛燃烧时先由固态转变为液态,再汽化,而后燃烧 |
| 用火柴迅速点燃刚熄灭时的白烟 | 白眼燃烧 | 白烟是石蜡的固体小颗粒 | |
2.结论:
综上所述,蜡烛能在空气中燃烧,发出黄白色火焰,放出热量,生成水并产生能使澄清石灰水变浑浊的气体——二氧化碳。
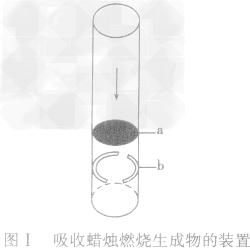
用来吸收蜡烛燃烧生成物的装置:
用燃烧蜡烛的方法验证质量守恒定律,为了保证正确的现象和结论,应如何设计实验装置?
蜡烛燃烧生成物为二氧化碳和水(气)。碱石灰能有效地吸收这两种物质。这种吸收装置的制作方法如下:
(1)截取一段长度为10cm,直径约为25mm的玻璃管(可用破了底的大试管截取)。
(2)装入金属网栅。从破旧石棉网上剪一块直径略大于玻璃管内径的圆网,从玻璃管的一端轻轻推入,使圆网撑住在离管口约2cm处作为放置碱石灰的网栅 (如网栅容易滑下,可以用回形针改制成一个带有弹性的圆环,弹紧在玻璃管的内壁作为挡圈,使网栅不致滑下).装置如图I所示。
(3)加入碱石灰,制成吸收器。碱石灰要选较大的颗粒,使间隙较大,保证气体流通。碱石灰层厚约4— 5cm。
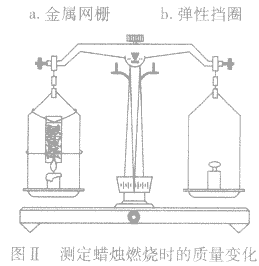
(4)将吸收器固定在天平左盘蜡烛的正上方(如图 Ⅱ),即可进行实验。
(5)这一实验成败关键在于蜡烛是否正常燃烧,生成的气体是否顺利通过吸收器。所以,蜡烛火焰的大小、吸收器离火焰的距离都要事先试验好。如果实验正常,3min后即有明显现象。天平最好选用感量为 0.02g的物理天平。
混合物的分离和提纯(除杂)
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。二者的方法在很多情况下是相似的,但分离比提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化而分离后还要复原为原来的组分物质提纯和除杂过程中经常用到分离操作,二者有时又密不可分。
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl3,溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl3中的少量Fe2(SO4)3应选用BaCl2而不应选用Ba(NO3)2,否则发生反应3Ba(NO3)2+Fe2(SO4)3==3BaSO4↓+2Fe(NO3)3溶液中又增加了Fe(NO3)3.
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
常见除杂的方法:
CO2(O2):将气体通过灼热的铜网
CO2(H2或CO):将气体通过灼热的氧化铜
O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂
O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中
Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤
Fe(含Cu):用磁铁将铁粉吸引出来
Cu(含CuO),Fe(含Fe2O3):高温下与H2或CO反应
CuO(含Cu或C):在空气中灼烧
CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2)
CaCO3(含CaO):加足量水溶解,过滤,取滤渣
Ca(OH)2(含CaO)加足量水
FeSO4溶液(含H2SO4或CuSO4),FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液
NaCl溶液(含Na2CO3):加适量稀盐酸
Na2SO4溶液(含CuSO4):加适量 NaOH 溶液
酸、碱、盐溶液的除杂技巧:
1.被提纯物与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去Na2SO4溶液中的NaOH:可选用稀H2SO4溶液为除杂试剂(2NaOH+ H2SO4==Na2SO4+2H2O)、除去KCl溶液中的 K2SO4:可选用BaCl2溶液为除杂试制(K2SO4+BaCl2 ==2KCl+BaSO4↓,过滤除去)
2.被提纯物与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂,如除去NaCl溶液中的BaCl2:可选用 Na2SO4溶液为除杂试剂(BaCl2+Na2SO4=BaSO4↓ +2NaCl,过滤除去).再如除去KNO3溶液中的AgNO3:可选用KCl溶液为除杂试剂(AgNO3+KCl=AgCl↓ +KNO3,过滤除去)。
3.被提纯物质与杂质所含阴离子、阳离子都不相同时,应选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如:除去NaCl溶液中的CuSO4:可选用Ba(OH)2溶液为除杂试剂[CuSO4+Ba(OH)2= BaSO4↓+Cu(OH)2↓,过滤除去]。
分离和提纯的方法:
物质的分离和提纯有两种主要的方法,即物理方法和化学方法。实际上在实验过程中往往需通过综合法来进行。
(1)物理方法主要包括过滤,蒸馏,结晶
(2)化学方法
(3)综合法
在进行混合物的分离或提纯时,采用一种方法往往不能达到目的,而要采用几种方法才能完成,这就是综合法。综合法主要有三种:
①物理方法的综合:主要是溶解、过滤、蒸发、结晶等方法的结合:
②化学方法的综合:当某物质所含杂质不止一种时,通常需加入多种试剂除去(或分离)不同的物质。
③物理与化学方法的综合:当某物质所含杂质不止一种,且有能用物理方法除去(或分离)的杂质时,首先应考虑用物理方法除去一种或几种杂质,然后再用化学方法除去其余杂质。
(4)除杂方法的几个优化原则
①若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
②应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
③先考虑物理方法,再用化学方法。
常见的混合物类型及分类与提纯的方法见下表:
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。二者的方法在很多情况下是相似的,但分离比提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化而分离后还要复原为原来的组分物质提纯和除杂过程中经常用到分离操作,二者有时又密不可分。
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl3,溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl3中的少量Fe2(SO4)3应选用BaCl2而不应选用Ba(NO3)2,否则发生反应3Ba(NO3)2+Fe2(SO4)3==3BaSO4↓+2Fe(NO3)3溶液中又增加了Fe(NO3)3.
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
常见除杂的方法:
CO2(O2):将气体通过灼热的铜网
CO2(H2或CO):将气体通过灼热的氧化铜
O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂
O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中
Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤
Fe(含Cu):用磁铁将铁粉吸引出来
Cu(含CuO),Fe(含Fe2O3):高温下与H2或CO反应
CuO(含Cu或C):在空气中灼烧
CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2)
CaCO3(含CaO):加足量水溶解,过滤,取滤渣
Ca(OH)2(含CaO)加足量水
FeSO4溶液(含H2SO4或CuSO4),FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液
NaCl溶液(含Na2CO3):加适量稀盐酸
Na2SO4溶液(含CuSO4):加适量 NaOH 溶液
酸、碱、盐溶液的除杂技巧:
1.被提纯物与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去Na2SO4溶液中的NaOH:可选用稀H2SO4溶液为除杂试剂(2NaOH+ H2SO4==Na2SO4+2H2O)、除去KCl溶液中的 K2SO4:可选用BaCl2溶液为除杂试制(K2SO4+BaCl2 ==2KCl+BaSO4↓,过滤除去)
2.被提纯物与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂,如除去NaCl溶液中的BaCl2:可选用 Na2SO4溶液为除杂试剂(BaCl2+Na2SO4=BaSO4↓ +2NaCl,过滤除去).再如除去KNO3溶液中的AgNO3:可选用KCl溶液为除杂试剂(AgNO3+KCl=AgCl↓ +KNO3,过滤除去)。
3.被提纯物质与杂质所含阴离子、阳离子都不相同时,应选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如:除去NaCl溶液中的CuSO4:可选用Ba(OH)2溶液为除杂试剂[CuSO4+Ba(OH)2= BaSO4↓+Cu(OH)2↓,过滤除去]。
分离和提纯的方法:
物质的分离和提纯有两种主要的方法,即物理方法和化学方法。实际上在实验过程中往往需通过综合法来进行。
(1)物理方法主要包括过滤,蒸馏,结晶
| 方法 | 适用范围 | 举例 | 注意事项 |
| 过滤 | 分离不溶性固体和液体 | 粗盐提纯 | ①过滤时要“一贴、二低,三靠”; ②必要时要洗涤沉淀物 |
| 结晶 | 利用混合物中各组分在某种溶剂中溶解度随温度变化不同的性质来分离提纯物质 | 分离氯化钠和硝酸钾混合物 | ①一般先配较高温度下的浓溶液,然后降温结晶: ②结晶后过滤,分离出晶体 |
| 蒸馏 | 沸点不同的液体混合物 | 石油的分馏 | ①温度计水银球在蒸馏烧瓶的支管口处; ②加沸石(或碎瓷片); ③冷凝管水流方向 |
(2)化学方法
| 除杂方法 | 除杂原理 | 应用实例 |
| 化气法 | 与杂质反应生成气体而除去 | 除Na2SO4中的NaCO3,可加适量稀盐酸 NaCO3+H2SO4==Na2SO4+CO2↑+H2O |
| 沉淀法 | 将杂质转化为沉淀过滤除去 | 除去NaCl中的Na2SO4.可加适量的BaCl2 Na2SO4+BaCl2==BaSO4↓+2NaCl |
| 置换法 | 将杂质通过置换反应而除去 | c除去FeSO4中的CuSO4可加过量的铁粉 CuSO4+Fe==Cu+FeSO4 |
| 溶解法 | 将杂质溶丁某种试剂而除去 | 除C粉中的CuO粉末,可加适量稀盐酸,再过滤 CuO+H2SO4==CuSO4+H2O |
| 加热法 | 杂质受热易分解,通过加热将杂质除去 | 除CaO中的CaCO3可加热 CaCO3  CaO+CO2↑ CaO+CO2↑ |
| 转化法 | 将杂质通过化学反应转化为主要成分 | 除去CO2中的CO,可将气体通过灼热的CuO CO+CuO  Cu+CO2 Cu+CO2 |
(3)综合法
在进行混合物的分离或提纯时,采用一种方法往往不能达到目的,而要采用几种方法才能完成,这就是综合法。综合法主要有三种:
①物理方法的综合:主要是溶解、过滤、蒸发、结晶等方法的结合:
②化学方法的综合:当某物质所含杂质不止一种时,通常需加入多种试剂除去(或分离)不同的物质。
③物理与化学方法的综合:当某物质所含杂质不止一种,且有能用物理方法除去(或分离)的杂质时,首先应考虑用物理方法除去一种或几种杂质,然后再用化学方法除去其余杂质。
(4)除杂方法的几个优化原则
①若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
②应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
③先考虑物理方法,再用化学方法。
常见的混合物类型及分类与提纯的方法见下表:
| 混合物类型采用的方法 | 物理方法 | 化学方法 | |
| 固—固混合 | 可溶—可溶 | 结晶 | 把杂质变成沉淀、气体等除去 |
| 可溶—不溶 | 过滤 | —— | |
| 不溶—不溶 | — | 把杂质变成可溶物除去 | |
| 固—液混合 | 过滤 | —— | |
| 液—液混合 | —— | 把杂质变成沉淀,气体或被提纯物 | |
| 气—气混合 | —— | 把杂质变成固体、溶液或被提纯物 | |
物质的鉴别:
根据不同物质的特性,用化学方法把两种或两种以上的已知物质一一区别开。
鉴别时只需利用某一特征反应,确定某物质的一部分就可达到鉴别的目的。且已知n种,确定n-1种,则余下的既为可知。
鉴别物质常用的方法:
(一)、物理方法:
“看、闻、摸、溶、吸”等方式进行鉴别。“看”就是要看物质的颜色、状态、形状等,“闻”可以闻某些气体的气味,“摸”可以通过摸容器的外壁,感觉是否有热量的改变,“溶”看物质是否能溶解,“吸”看是否能被磁铁吸引。如:硫酸铜溶液是蓝色的、氯化铁溶液是棕黄色的、其它常见的物质只要不含Cu2+和Fe3+的化合物的水溶液一般都是无色的,大理石是块状固体、氢氧化钠是片状固体、氢氧化钙是粉末状固体,氢气和氧气是气体、酒精有是液体
(二)、化学方法:
就是通过不同的物质在与同一种物质发生化学反应时所产生的现象不同把它们鉴别开的方法,它是鉴别物质的常用方法。下面根据物质的构成的特点,分析在化学上常用的鉴别方法。
1、含“H+”的化合物(如HCl、H2SO4)的鉴别方法。
(1)用紫色的石蕊试液。酸溶液都能使紫色的石蕊试液变成红色,如硫酸溶液能使紫色的石蕊试液变成红色。
(2)用PH试纸。酸(含H+的化合物)溶液的PH<7,如:醋酸溶液的PH<7。
(3)用镁、铝、锌、铁等活泼金属。这些金属与酸反应产生的明显现象是,有无色气体生成。如:Mg+H2SO4==MgSO4+H2↑
(4)用含有“CO32-”的物质,如:碳酸钠与盐酸反应产生无色的气体,该气体能使澄清的石灰水变浑浊。
例1:设计实验鉴别两种无色溶液一种是硫酸,一种是氢氧化钠。分析:硫酸是酸性溶液,而氢氧化钠是碱性溶液。所以上述四种方法都可以用来鉴别这两种物质。
2、含“OH-”的化合物(如NaOH、Ca(OH)2)的鉴别方法。
(1)用紫色的石蕊试液或者无色的酚酞试液。观察到的现象是:含OH-的化合物才能使紫色的石蕊试液变成蓝色,能使无色的酚酞试液变成红色。
(2)用PH试纸。含OH—的化合物的水溶液的PH>7
(3)用含有Cu2+等离子的盐溶液,会产生不同颜色的沉淀。
例2:有氯化钠、氢氧化钙和盐酸三种无色溶液,怎样实验的方法加以鉴别。分析:以上三种物质分别是盐、碱和酸三类,因此最好用紫色的石蕊试液进行鉴别,变成蓝色的是氢氧化钙,变成红色的是盐酸,不变色的是氯化钠溶液。
3、含“CO32-”的化合物(如Na2CO3)的鉴别方法。最常用的方法是稀盐酸和澄清的石灰水,看到的现象是:加入稀盐酸后有无色气体产生,该气体能使澄清的石灰水变浑浊。
例3:有碳酸钠溶液、氢氧化钠溶液两种无色液体,怎样鉴别它们。分析:由于两种溶液都显碱性,所以不能使用酸碱指示剂。可向两种溶液中分别加入少量的稀盐酸,再反生成的气体通入到澄清的石灰水中。
4、含有“Cl-”的化合物(NaCl等)的鉴别方法。鉴别含“Cl”的化合物依据的原理是:它与含“Ag+”的化合物结合成AgCl,它是一种不溶于水也不溶于酸的沉淀。
例4,实验室里有两瓶失去标签的无色溶液,只知它们是氯化钠和硝酸钠,设计实验鉴别它们。分析:两种无色溶液中的阳离子都是钠离子,没有办法进行鉴别,但可以根据氯化钠与硝酸银溶液反应生成白色氯化银的沉淀,而硝酸钠与硝酸银不发生反应的原理反两种化合物的溶液鉴别开。
5、含“SO42-”的化合物(如Na2SO4)有鉴别方法。鉴别这类化合物的原理是:SO42-离子与Ba2+离子结合成不溶于水也不溶于酸的白色沉淀。
例5,设计一个实验鉴别两种无色溶液是硫酸钠溶液和氯化钠溶液。分析:根据上述原理,可用含“Ba2+”的化合物,常用的是氯化钡溶液,有白色沉淀生成的是硫酸钠溶液,无明显现象产生的溶液是氯化钠溶液。比照上述方法大家还可以尝试着总结出多种鉴别物质的方法。比如:鉴别含有“NH4+”的化合物常用含有“OH-”的化合物等。还需要说明的是鉴别物质是相互的,比如,前面讲到的可以用含“Ba2+”的化合物鉴别含有“SO42-”的化合物;也可以用含有“SO42-”的化合物鉴别含“Ba2+”的化合物。
例6,只用一种试剂通过一次实验就能把硝酸钾溶液、氢氧化钡溶液、氯化钡溶液、氢氧化钠溶液鉴别出来。分析:硝酸钾溶液中含有的K+和NO3-在初中还没有学过鉴别的方法,我们可以把它留在最后无现象的物质鉴别出来;氢氧化钡溶液中的Ba2+用SO42-进行鉴别,而OH-可用Cu2+等有颜色的离子进行鉴别;硫酸钠溶液中的Na+目前还没有鉴别方法,但Ba2+能用用SO42-进行鉴别;同理氢氧化钠溶液也可用Cu2+等有颜色的离子进行鉴别。
日常生活中一些物质的检定检验方法:
(1)鉴别聚乙烯和聚氯乙烯塑料(聚氯乙烯塑料袋有毒,不能装食品) 点燃后闻气味,有刺激性气味的为聚氯乙烯塑料。
(2)鉴别羊毛线、合成纤维线或棉线(采用燃烧法) 点燃,产生烧焦羽毛气味,不易结球的为羊毛线;无气味,易结球的为合成纤维线。燃烧,产生烧纸味,不结球的是棉线。
(3)鉴别硬水和软水用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水。
(4)鉴别氢气、氧气、一氧化碳、二氧化碳和甲烷先用燃着的木条:使燃着的木条烧得更旺的是氧气,使燃着的木条熄灭的是二氧化碳;能燃烧的气体是氢气、甲烷、一氧化碳。进一步检验可燃性气体氢气、甲烷、一氧化碳燃烧后的产物:用干燥的烧杯罩在火焰上方,有水生成的是氢气和甲烷,无水生成的是一氧化碳;燃烧后生成的气体通入澄清石灰水,能使澄清石灰水变浑浊的是甲烷和一氧化碳。
(5)真假黄金假黄金通常是用铜锌合金伪造的,可用盐酸加以鉴别,如有气泡产生,说明该物质中含锌,是假黄金;也可灼烧,变黑,说明有铜,是假黄金。
(6)热固性塑料和热塑性塑料取样,加热,能熔化的是热塑性塑料,不能熔化的是热固性塑料。
鉴别题的解答思路:
1. 只用一种试剂的鉴别题:
根据待鉴别的几种物质性质特点,加一种试剂,使各自出现明显不同的现象加以鉴别。
思路:
(1)如果待检验的物质之间有明显的酸碱性差异时,可选用适当的指示剂或PH试纸检验。
如用一种试剂检验盐酸、氯化钠、碳酸钠三种溶液,这种试剂是紫色石蕊试液。
(2)如果待检验的物质之间有较明显的溶解性差异和溶解时的热效应差异,则可用加水使其溶解来检验。
如用一种试剂检验:氯化钠、氯化铵、氢氧化钠、氯化银四种固体物质,这种试剂就是水。氯化钠可溶于水,溶解后溶液温度五显著变化;氯化铵易溶于水,溶解后溶液温度显著降低;氢氧化钠易溶于水,溶解后溶液温度显著升高,而氯化银不溶于水。
(3)如果待检验的物质含有相同的阴离子或大多数相同的阴离子时,可选用加强碱溶液来检验。
如用一种试剂检验:氯化铵、氯化钠、氯化铁和氯化镁四种溶液,这种试剂就是氢氧化钠溶液。氯化铵与氢氧化钠溶液反应后有能使湿润的红色石蕊试纸变蓝的氨气产生,氯化钠不与氢氧化钠反应,无现象发生;氯化铁与氢氧化钠溶液反应后有白色的氢氧化镁沉淀生成。
(4)如果被鉴别的物质中含有相同或大多数相同的阳离子时,可选择强酸为试剂进行鉴别。
如用一种试剂鉴别氯化钠、碳酸钠、亚硫酸钠三种溶液,这就是盐酸或稀硫酸。氯化钠与盐酸或硫酸不反应,无现象产生;碳酸钠与盐酸或硫酸反应,产生无色无味的二氧化碳气体;亚硫酸钠与盐酸或硫酸反应产生无色有刺激性气味的二氧化硫气体。
(5)如果被鉴别的物质为金属单质和金属氧化物时,可选择强酸为试剂进行鉴别。
如用一种试剂鉴别铁、铜、氧化铁、氧化铜四种固体物质,这种试剂是稀盐酸(或稀硫酸)。铁与盐酸反应有气体(氢气)产生,生成浅绿色溶液;铜不溶于盐酸,无现象产生;氧化铁溶于盐酸生产黄色的氯化铁溶液;氧化铜溶于盐酸生成蓝色的氯化铜溶液。
(6)如果被鉴别的物质有几种含有相同的阳离子,有几种含有相同的阴离子,则要分别考虑区别不同阳离子需要何种离子,区别不同阴离子需要何种离子,然后将这两种离子合起来组成一种试剂。
如用一种试剂鉴别硝酸银、碳酸钠、亚硫酸钠、硝酸钡四种物质,这种试剂是盐酸。因为四种物质中,硝酸银和硝酸钡的阳离子不同,。区别银离子和钡离子可用氯离子;碳酸钠和亚硫酸钠的阴离子不同,区别亚硫酸根离子和碳酸根离子可用氢离子,合起来,这种试剂就是盐酸。
(7)还有另一种比较快速地找出试剂的方法。就是将所用试剂的离子重新组成新试剂,如果组合后的试剂答案中有,则一般地就可以认为用这一种试剂可以把这种物质区别开。
2. 不用任何试剂鉴别多种物质的思路:
(1)从被鉴别的物质的物理性质上找突破口:
①闻气味
如不用任何试剂鉴别氨水、硫酸钾、氯化镁、碳酸钠四种溶液。可先闻气味,氨水有强烈的刺激性气味,首先识别出氨水,然后以氨水为试剂,分别加入到另外三种溶液中,有白色沉淀产生的是氯化镁,再以氯化镁为试剂分别加到剩余的两种溶液中,产生白色沉淀的为碳酸钠,不反应的为硫酸钾。
②看颜色
如不用任何试剂鉴别硝酸铵、氯化钡、硫酸铜、氢氧化钠四种溶液。首先观察出显蓝色的是硫酸铜溶液,以硫酸铜为试剂分别加到另外三种溶液中,产生蓝色沉淀的是氢氧化钠溶液,产生大量白色沉淀的是氯化钡溶液,无现象产生的是硝酸铵溶液。
(2)加热法:
如,不用任何试剂鉴别碳酸氢钠、碳酸氢铵、高锰酸钾、碳酸钠四种固体物质,即可加热法。加热时,碳酸氢铵完全分解成二氧化碳、氨气、水蒸气,试管内无任何残留物;碳酸氢钠受热分解有气体产生,试管内留有白色固体碳酸钠;高锰酸钾受热分解产生氧气,可使带火星的木条复燃,试管内留有黑色固体;碳酸钠受热时不分解,无现象产生。
(3)两两混合列表分析法:
将待鉴别的物质分别编号,分别以一种物质作为试剂加入到其它物质中去,将产生的现象列表分析。根据每种物质所产生的不同现象,可确定物质的名称。
如不用任何试剂鉴别氯化钡、硝酸银、碳酸钠、盐酸四种溶液,先将四种溶液分别编为A、B、C、D进行互倒实验,将现象列表如下:

然后进行分析:在四种物质中,能跟另外三种物质反应产生沉淀的只有硝酸银,因此B是硝酸银;能跟其中两种物质反应产生沉淀而跟另一种物质反应产生气体的只有碳酸钠,因此C是碳酸钠;而能跟碳酸钠反应产生气体的物质D必是盐酸;那么A必然是氯化钡。结论为:A是氯化钡,B是硝酸银,C是碳酸钠,D是盐酸。 有时,需要我们判断所给定的一组物质能否不用任何试剂进行鉴别,分析的方法就是用两两混合列表法。如果有两种或两种以上物质产生的现象是一样的,则不能鉴别。
如上例中如果将氯化钡改成氯化钠则不可鉴别。因为碳酸钠和盐酸分别产生的现象都是与一种物质不反应,与一种物质反应产生沉淀,与一种物质反应产生气体,二者谁是碳酸钠,谁是盐酸,无法确定。
不另加试剂鉴别物质的方法有:第一是观察组内物质是否有显特殊颜色的物质,是否有不溶于水的物质等,将这些物质确定后,就以其作为已知试剂用以鉴别其它物质。第二是将组内物质分别编号,然后分别以一种物质作为试剂加入另外几种物质中,将现象记录下来。如果不能得到各自不同的现象,则这组物质就还需另加试剂才能鉴别。
发现相似题
与“下列家庭小实验的设计方案中,不能达到预期实验目的的是[ ]A...”考查相似的试题有:
- 除去下列各组物质中的杂质,所选用的试剂及操作方法均正确的是(括号内的物质为杂质,所选试剂均足量)[ ]选项物质选用试剂及...
- 分别用一种试剂将下列物质中混入的少量杂质除去.(括号中是混入的杂质)物质需加入试剂有关化学方程式 ①HNO3(H2SO4) ②Cu粉...
- 下列除杂质的方法中错误的是( )A.物质:稀硫酸,少量的杂质:铜,除杂的方法:过滤B.物质:氯化钙溶液,少量的杂质:稀盐...
- 氢氧化钠溶液为什么易变质?如何检验一瓶经常使用的氢氧化钠溶液是否变质?如何除去变质后生成的杂质?
- 食盐、食醋、纯碱等为家庭厨房中常用的物质.利用这些物质,你能完成的实验是( )①检验自来水中是否含有氯离子 ②鉴别食盐和...
- 化学课上,周老师向我们展示了两瓶无标签的溶液,说:“它们分别是稀盐酸和氢氧化钠溶液。请同学们设计不同的方案,然后动手实...
- 已知常用的强酸(H2SO4、HCl、HNO3)跟常用的强碱(NaOH、KOH)反应生成的盐的水溶液显中性,现将某白色粉末溶入一无色中性液...
- 《幸运52》你喜欢看吗?现在就请你身临其境、积极参与进来吧,下面请你对所设置问题进行回答:(1)这是空气中的一种气体,它...
- ①某化工厂有甲、乙两个车间,排出的废水澄清透明,分别含有三种不同的离子,共有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子(...
- A为含三种元素的钠盐,C为相对分子质量为100的白色不溶物,请完成下列问题:(1)写出下列物质的化学式A______B______C______...