本试题 “强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol以下4个热化学方程式中,①H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)②H...” 主要考查您对中和热
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 中和热
中和热:
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: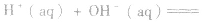
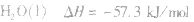
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法:
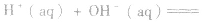
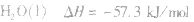
影响中和热测定的因素:
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项:
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
发现相似题
与“强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)═H2O...”考查相似的试题有:
- 火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成, WC=40%,WH=13.33%,其分子量为60。通过结构分析可知...
- 下列推论正确的是( )A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>bB.C(石墨,s)===C(金刚石,s) Δ...
- 氢气可以在氧气中燃烧。在该反应中:断裂1mol H—H键消耗的能量为Q1kJ,断裂1 mol O=O键消耗的能量为Q2kJ,形成1mol H—O键释放...
- 下列说法正确的是[ ]A.需要加热才能发生的反应都是吸热反应B.C(s)+1/2O(g)=CO(g);ΔH=-110.5 kJ·mol-1,则碳的燃烧热...
- 已知在25℃,101kPa下,1g(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )A....
- 已知在298K时的有关数据:C(s)+1/2O2(g)===CO(g);ΔH1=-110.5kJ·mol-1;C(s)+O2(g)===CO2(g);ΔH2=-393.5kJ·mol-1。...
- 已知: C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/molTiO2(s)+2Cl2(g)=TiCl4(s)+O2(g...
- (3分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。
- 含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.4kJ的热量,下列能正确表示中和热的热化学方程式是A.KOH(aq) + 1/2...
- 氨有着广泛的用途,可用于化肥、硝酸、合成纤维等工业生产。(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,...