本试题 “《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量.即:H2(g)+...” 主要考查您对甲烷
燃料和能源(氢能、风能、核能、太阳能等)
工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 甲烷
- 燃料和能源(氢能、风能、核能、太阳能等)
- 工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)
(1)结构式:
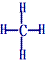 、球棍模型:
、球棍模型:  、比例模型:
、比例模型: 
空间构型为正四面体。
(2)物理性质:无色无味的气体,密度0.717g/L,记忆溶于水。
(3)化学性质:通常情况下甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸强碱不反应,可发生氧化反应、取代反应
①氧化反应:CH4+O2
 CO2+2H2O
CO2+2H2O ②取代反应:CH4+Cl2
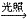 CH3Cl+HCl,甲烷在光照条件下反应,现象:试管内气体颜色逐渐变浅,试管壁上有油状液滴,试管中有少量白雾。甲烷中四个氢原子都可以与氯气发生取代,甲烷的4中氯代产物都不溶于水,常温下,一氯甲烷是气体,其他都为液体,三氯甲烷俗称氯仿。
CH3Cl+HCl,甲烷在光照条件下反应,现象:试管内气体颜色逐渐变浅,试管壁上有油状液滴,试管中有少量白雾。甲烷中四个氢原子都可以与氯气发生取代,甲烷的4中氯代产物都不溶于水,常温下,一氯甲烷是气体,其他都为液体,三氯甲烷俗称氯仿。 甲烷与氯气等卤素单质反应的注意事项:
1.反应条件为光照,在室温或暗处不发生反应,但不能用强光直接照射,以免引起爆炸。
2.甲烷与溴蒸气、碘蒸气等纯卤素也能发生类似反应,但不能与溴水、碘水发生反应。
3.甲烷与氯气的反应是一种连锁反应,不会停留在某一步,因此产物一般是五种物质的混合物。
4.CH4与Cl2在光照条件反应,生成物中HCl的物质的量最多。
5.1mol有机物CxHy与Cl2发生完全取代反应时,消耗Cl2的物质的量为ymol。
原子共面的判断方法:
判断有机物分子中的原子是否共面,首先要熟悉常见的分子构型。如甲烷分子(CH4)为正四面体结构,其分子中最多有三个原子共面;乙烯分子 (CH2=CH2)中的所有原子共面;苯分子(C6H6)中的所有原子共面。在判断有机物分子中原子共面情况时,把要分析的分子看做是简单的常见分子的衍生物,即复杂问题简单处理
(1)在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,即甲烷分子中有且只有三个原子共面。当甲烷分子中的某个氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在原来的平面上。
(2)乙烯分子中所有原子在同一平面内,键角为 120。。当乙烯分子中的某个氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯分子所在的平面内。
(3)苯分子中所有原子在同一个平面内,键角为 120。。当苯分子中的某个氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在苯分子所在的平面内。说明有机化合物分子中的单键(包括碳碳单键、碳氢单键、碳氧单键等)可以旋转;而双键、三键不能旋转
1.能源的分类:

2.各种能源的特点:
(1)传统燃料。柴草是农村使用的重要能源,但它的利用率低,且污染严重。
(2)化石燃料。这是人们目前使用的主要能源,它们的蕴藏量有限,而且不能再生,最终会枯竭,属于不可再生能源。
(3)新能源。新能源来源丰富,多数可以再生,没有污染或污染很小,所以可能成为未来的主要能源,但它们也有自己的缺点,如太阳能的能量密度低,使用成本高;氢能储仔、运输困难;风能不稳定,受地区、季节、气候的影响大。
3.我国的能源状况
(1)能源种类。我国的能源种装有化石燃料、水能和核能,其中化石燃料和水能的人均值太低,核能—一铀已探日月的储量很低,仅够4000万干瓦核电站运行 30年。
(2)我国能源的总消费量和人均消费量从改革开放以来~直到1995年逐年增加,从1995年开始有减少的趋势。
(3)我国能源利用率低,只有9%,能源节约的空间很大。
4.使用化石燃料的利弊及新能源的开发
(1)燃料充分燃烧的两个条件:
①要有足够的空气;
②燃料与空气要有足够大的接触面积。
(2)重要的化石燃料:煤、石油、天然气
(3)煤作燃料的利弊问题:
①煤是重要的化工原料;
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染;
③煤作为固体燃料,燃烧反应速率小,热利用率低,且运输不方便;
④可以通过清洁煤技术,如煤的液化和气化以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(4)新能源的开发:
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发新能源等;
②现在正在探索的新能源有太阳能、地热能、海洋能、生物质能、风能和氢能等。
1.确定化工生产的最佳过程
确定化工生产反应原理与过程的一般方法:对于某一具体的化工产品,研究生产过程要从产品的化学组成和性质考虑,来确定原料和生产路线。
①分析产品的化学组成,据此确定生产产品的主要原料;
②分析产品与生产原料之间关键元素的性质,确定主要生产步骤;
③分析生产原料的性质.确定反应原理。
2.选择化工生产的最佳原料
选择原料首先要考虑化学反应原理,此外还要考虑厂址选择、原料供应、能源供应、工业用水供应、产品存储、产品运输、产品预处理成本、环境保护等。
3.控制最佳化学反应条件
控制反应条件是取得化工生产最佳综合效益的重要环节之一。控制反应条件要应用化学反应速率理论和化学平衡原理,结合具体化学反应的特点以及生产技术和设备条件、能源消耗等,控制最佳化学反应速率和反应物的平衡转化率。
4.科学治理工业“三废”
“三废”主要是指废气、废液和废渣。治理“三废” 首先要从设计生产工艺与选择原料做起,即从源头上解决问题;其次是把好排放关,对排出的“三废”的处理,要尽最大努力使其资源化,最低要求是无害化。
5.充分利用“废热”
通过热交换或其他方式利用化学反应所放出的热量。
硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2 Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3 Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2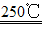 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4 K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH- 总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2 接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
与“《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学...”考查相似的试题有:
- 天然气的主要成分是A.一氧化碳和氢气B.甲烷C.乙烯D.乙烷
- A、B、C、D、E、F、G、H、I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:①A、B、E、F、G能使湿润的蓝色石...
- 下列关于有机物的叙述不正确的是[ ]A. 甲烷和乙烯可以用酸性高锰酸钾溶液鉴别B. 乙酸和油脂都能与氢氧化钠溶液反应C. 蛋白质...
- 有7种物质:①甲烷;②苯;③聚乙烯;④乙烯;⑤己烷;⑥甲苯;⑦环己烯.因为发生化学反应,既能使酸性高锰酸钾溶液褪色又能与溴水...
- 据报道,某煤矿井下采煤面瓦斯突出,发生爆炸,当场造成56人死亡,92人生死不明。截至记者发稿时,经过全力搜救,目前又发现4...
- 联合国气候变化大会于2009年12月7日~18日在丹麦首都哥本哈根召开,焦点议题之一是发展“低碳经济”,减少温室气体排放.你认为...
- 化学与生活、社会密切相关。下列说法不正确的是[ ]A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境B.凡含有...
- 某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④...
- 氢溴酸在医药和石化工业上有广泛甩途。下图是模拟工业制备氢溴酸粗品并精制的流程根据上述流程回答下列问题:(1)混合①中发生...
- 为了节能减排,提高综合经济效益,某工厂采用焦炉气--含硫烟道气联合生产硫酸铵和亚硫酸氢铵两种产品,其工艺流程图如下(1)...