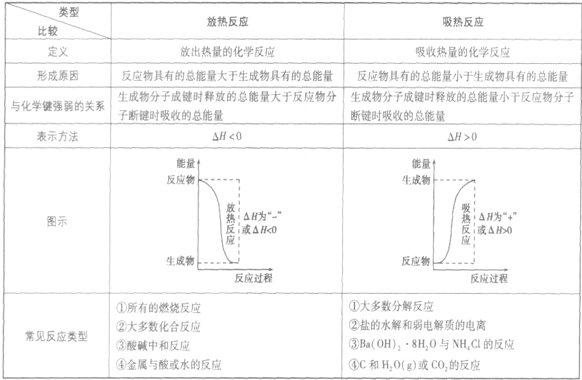
本试题 “下列图示与对应的叙述不相符的是[ ]A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液B.图2表示某放热反应分别在有、无催化剂的情况下...” 主要考查您对离子反应
吸热反应、放热反应
酸碱中和滴定
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子反应
- 吸热反应、放热反应
- 酸碱中和滴定
凡是有离子参加或离子生成的反应都是离子反应。
离子反应包括:复分解反应、氧化还原反应、络合反应、双水解反应
常见阳离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| K+ | 焰色反应 | ①铂丝在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。 | 浅紫色(通过蓝色钴玻璃片观察钾离子焰色) | —— |
| Na+ | 焰色反应 | 火焰分别呈黄色 | ||
| NH4+ | NaOH溶液(浓) | 向未知溶液中加入NaOH浓溶液并加热 | 生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体 | NH4++OH-=NH3↑+H2O |
| Al3+ | 加NaOH溶液 | 向未知溶液中加入NaOH溶液 | 加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中 |
Al3++3OH-=Al(OH)3↓ |
| Cu2+ | 浓氨水 | 向未知溶液中加入浓氨水 | 加入适量浓氨水后生成蓝色沉淀,该沉淀溶于过量浓氨水中,溶液呈深蓝色 |
Cu2++2OH-=Cu(OH)2↓ Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O |
| Ag+ | ①稀盐酸或可溶性盐酸盐②稀HNO3③氨水 | 向未知溶液中加入稀盐酸再加入稀HNO3向过滤出的沉淀中加氨水 | 生成白色沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+ | Ag++Cl-=AgCl↓ |
| Ba2+ | 稀H2SO4或可溶性酸盐溶液 | 向未知溶液中加入稀H2SO4再加入稀HNO3 | 产生白色沉淀,且沉淀不溶于稀HNO3 | Ba2++SO42-=BaSO4↓ |
| Fe3+ | KSCN溶液 | 向未知溶液中加入KSCN溶液或加NaOH溶液或加苯酚 | 变为血红色溶液 | Fe3++3SCN-=Fe(SCN)3 |
| 加NaOH溶液 | 产生红褐色沉淀 | Fe3++3OH-=Fe(OH)3↓ | ||
| 加苯酚 | 溶液显紫色 | Fe3++6C6H6OH→[Fe(C6H5O)]3-+6H+ | ||
| Fe2+ | ①加NaOH溶液 | 向未知溶液中加入NaOH溶液并露置在空气中 | 开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。 | Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| ②KMnO4 (H+)溶液 | 向未知溶液中加入KMnO4(H+)溶液 | KMnO4(H+)紫色褪去 | MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O | |
| ③K3[Fe(CN)6] | 向未知溶液中加入K3[Fe(CN)6]溶液 | 出现蓝色Fe3[Fe(CN)6]2沉淀 | 3Fe2++2[Fe(CN)6]-=Fe3[Fe(CN)6]2↓ | |
| ④KSCN溶液,新制的氯水 | 加入KSCN溶液,新制的氯水 | 加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。 | 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(SCN)3 |
常见阴离子的检验方法:
| 离子 | 检验试剂 | 实验步骤 | 实验现象 | 离子方程式 |
| CO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出无色无味气体 | Ba2++CO32-=BaCO3↓ BaCO3+2H+=Ba2++CO2↑+H2O |
| ②稀盐酸、Ca(OH)2溶液 | 加入稀盐酸后放出的气体通入使澄清的Ca(OH)2溶液 | 加入稀盐酸后放出无色无味气体,通入澄清的Ca(OH)2溶液变浑浊 | CO32-+2H+=H2O+CO2↑ Ca2++2OH-+CO2=CaCO3↓+H2O | |
| SO42- | BaCl2溶液、稀硝酸或稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ba2++SO42-=BaSO4↓ |
| SO32- | ①BaCl2溶液、稀盐酸 | 向未知溶液中加入BaCl2溶液再向沉淀中加入稀盐酸 | 加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体 | SO32-+2H+=H2O+SO2↑ |
| ②稀盐酸、品红溶液 | 加入稀盐酸后放出的气体通入品红溶液 | 加入稀盐酸后放出的气体使品红溶液褪色 | SO32-+2H+=H2O+SO2↑ | |
| Cl- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸或稀盐酸的白色沉淀 | Ag++Cl-=AgCl↓ |
| Br- | AgNO3溶液、稀硝酸或稀盐酸 | 生成不溶于稀硝酸或稀盐酸的浅黄色沉淀 | Ag++Br-=AgBr↓ | |
| I- | AgNO3溶液、稀硝酸或稀盐酸 | 向未知溶液中加入AgNO3溶液,再向沉淀中加入稀盐酸 | 生成不溶于稀硝酸的黄色沉淀 | Ag++I-=AgI↓ |
| ②新制氯水,淀粉溶液 | 向未知溶液中加入新制氯水,再加入淀粉溶液 | 滴入新制Cl2,振荡后再滴入淀粉溶液,变蓝 | Ag++I-=AgI↓ 2I-+Cl2=I2+2Cl- I2遇淀粉变蓝 |
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
酸碱中和滴定:
用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
(1)原理:对于一元酸和一元碱发生的中和反应,C酸V酸=C碱V碱 或:C未知V未知=C标准V标准,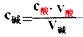
(2)仪器:a.酸式滴定管 b.碱式滴定管c.铁架台d.滴定管夹e.锥形瓶 f.烧杯g.胶头滴管等
(3)装置图: 
(4)操作步骤:
洗涤、检漏、水洗、润洗、装液、去泡、调液面记录、放待测液、加指示剂、滴定、记录、
计算、误差分析
(5)数据处理依据:
c(NaOH)=c(HCl)V(HCl)/V(NaOH)
(6)误差分析:
①仪器润洗不当:
a.盛标准液的滴定管用蒸馏水洗后未用标准液润洗;
b.盛待测液滴定(移液)管用蒸馏水洗后未用待测液润洗;
c.锥形瓶用蒸馏水洗后再用待测液润洗;
②读数方法有误:
a.滴定前仰视,滴定后俯视;
b.滴定前俯视,滴定后仰视;
c.天平或量筒的使用读数方法错误;
③操作出现问题:
a.盛标准液的滴定管漏液;
b.盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡
(或前无后有);
c.振荡锥形瓶时,不小心有待测液溅出;
d.滴定过程中,将标准液滴到锥形瓶外;
中和滴定中的误差分析:
中和滴定是一个要求较高的定量实验,每一个不当的或错误的操作都会引起误差。
对于一元酸与一元碱,由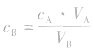 可知,
可知,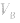 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于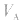 的大小,
的大小,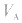 大则
大则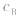 大,
大,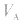 小则
小则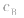 小。
小。
以标准酸溶液滴定末知浓度的碱溶液(酚酞作指示剂)为例,常见的不正确操作对实验结果的影响见下表: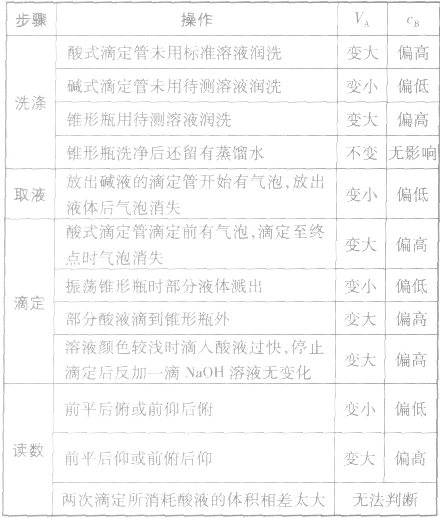
中和滴定应注意的问题:
1.中和滴定中指示剂的使用与选择
(1)用量不能太多,常用2~3滴,冈指示剂本身也是有机弱酸或有机弱碱,若用量太多,会使中和滴定中需要的酸或碱的量增多或减少。
(2)指示剂的选择:中和滴定时一般选用的指示剂有酚酞和甲基橙。石蕊试液由于颜色变化不明显,不易辨别,在滴定过程中不宜使用。
(3)酸、碱恰好完全反应时,终点溶液的pH应在指示剂的变色范围内,如强酸溶液滴定弱碱溶液应选用甲基橙作指示剂;强碱溶液滴定弱酸溶液应选用酚酞作指示剂。
(4)指示剂的变色:最好由浅到深,这样对比明显。如用强碱滴定强酸用酚酞作指示剂较好,当酚酞从无色变为粉红色(或浅红色)且半分钟内不褪色时即达到滴定终点。
2.欲减小实验误差的三点做法
(1)半分钟:振荡,半分钟内颜色不褪去,即为滴定终点。
(2)l一2min:滴定停止后,必须等待l~2min,让附着在滴定管内壁的溶液流下后,再进行读数。
(3)重复:同一实验,要做两到三次,两次滴定所用标准溶液的体积的差值不能超过0.02mL,再取平均值。
与“下列图示与对应的叙述不相符的是[ ]A.图1表示KNO3的溶解度曲...”考查相似的试题有:
- 向含有Mg2+、Fe2+、NH4+、Al3+的溶液中,加入过量的NaOH溶液,加热并搅拌,再加入过量盐酸,溶液中减少的阳离子是( )A.Mg2...
- 有一混合溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32—、SO42—,现取三份100 mL溶液进行如下实...
- 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴...
- 汽车尾气中的CO和氮氧化物对环境的危害较大,必须在排放前进行有效处理,下列是在汽车尾气处理装置中发生的一个反应: 2CO( g...
- 已知25℃、101kPa条件下:4Al (s)+3O2(g) =2Al2O3(s) △H =-2834.9 kJ/mol4Al(s)+3O3(g)=2Al2O3(s) △H =-3119.91kJ/m...
- 下列说法正确的是( )A.电解强酸强碱的水溶液时阳极上产生的都是氧气B.发生有效碰撞的分子一定是活化分子C.放热反应都需...
- 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次...
- 分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是[ ]①根据酸分子中含有的氢原子数将酸分为一元酸、二...
- 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节...
- (1)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:酸式滴定管用蒸馏水洗净后,...