本试题 “20gA物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD物质和0.2molE物质,则E物质的摩尔质量为( )A.100g/molB.108g/molC.55g/molD.96g/mol” 主要考查您对摩尔质量
物质的量的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 摩尔质量
- 物质的量的有关计算
摩尔质量:
定义:单位物质的量的物质所具有的质量
符号:M
单位:g/mol(g·mol-1)
计算公式:摩尔质量(M)=质量(m)/物质的量(n)
摩尔质量、相对分子质量、1mol物质的质量三者的区别和联系:
1mol物质的质量在数值上和摩尔质量相同,二者的区别在于单位不一样,质量的单位是千克(kg),而摩尔质量的单位是g/mol。相对分子质量与摩尔质量单位不同,但在数值上二者相等。
平均摩尔质量的计算方法:
- 已知混合物质的总质量m(混)和总物质的量n(混):M =m(混)/n(混)
- 已知同温同压下混合气体的密度ρ(混)是一种简单气体A的密度ρ(A)的倍数d(也叫相对密度)d= ρ(混)/ ρ(A),则M混= ρ混M混/ ρ(A)
- 在溶液中,M=1000ρw%/c(ρ指溶液的密度,w%指溶液中溶质的质量分数,c表示溶液的浓度)
- 已知某状况下的混合气体的密度M=ρVm(ρ表示气体的密度,Vm表示在该状况下的气体的摩尔体积)
- 已知混合物各成分的摩尔质量和其在混合体系内的物质的量分数或体积分数M=M1×n1%+M2×n2% =M1×V1%+M2×V2%
计算物质的量浓度时应注意的问题:
物质的量浓度是表示溶液组成的一个重要物理量,是高中化学的重要内容之一。应用时要注意以下几方面的问题:
1.注意溶质是什么
对有些特殊情况要注意辨别,不能出错。如SO2、CuSO4·5H2O等溶于水后所得溶液中的溶质分别为 H2SO4和CuSO4,进行有关氨水的浓度计算时以NH3 为溶质来计算等。
2.注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给溶液密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度时,则需通过密度求溶液的最终体积。
3.注意单位运算
在概念理解及应用中,要注意各物理量的单位.一是各物理量的单位要相互匹配,二是从单位运算人手.能简化解题思路,快速求解。
4.注意溶解度的影响
第一,物质的量浓度适用于表示不饱和及饱和溶液中溶质与溶剂的关系,不适用于过饱和溶液(溶质未溶解完全);
第二,注意一些典型问题,如Ca(OH)2的溶解度随温度变化情况及气体物质在溶剂中的溶解问题等。
5.注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶质物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
6.注意实验情景
在计算溶液配制或溶液稀释等问题中物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是配制溶液时,要注意容量瓶规格与所需溶液体积的关系。因容量瓶的规格是固定的,所以选用的容量瓶的规格要等于或略大于所需溶液的体积。
7.注意物质与其组成粒子的关系
物质与其组成粒子的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。如Na2SO4 溶液中c(Na+)=2c(SO42-)=2c(Na2SO4)。
以物质的量为核心的演绎公式:
1.溶液稀释定律
(1)对于已知质量分数溶液的稀释:稀释前后溶质的质量不变,即: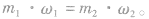
(2)对于已知物质的量浓度溶液的稀释:稀释前后溶质的物质的量不变,即: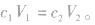
2.物质的量浓度与溶质质量分数的换算
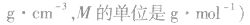
3.溶解度S与溶质质量分数ω的换算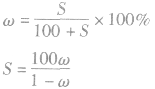
4.溶解度与饱和溶液物质的量浓度的换算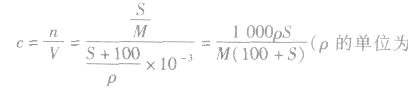

5.标准状况下气体溶于水后所得溶液的物质的量浓度的计算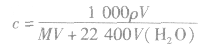
式中V为标准状况下气体的体积(L),V(H2O)为水的体积(L),ρ为溶液的密度(g·cm-3)。
6.相对密度(D)的计算及意义两种气体在同温同压下的密度之比即为相对密度,显然,它等于相对分子质量(或摩尔质量)之比,即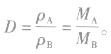
与“20gA物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD物质...”考查相似的试题有:
- 下列说法正确的是( ) A.1molCO2含有2molO B.2molCO2含有2molO C.CO2的摩尔质量是44 D.1molCO2的质量是44g•mol-1
- 氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过...
- 下列叙述中正确的是[ ]A.1mol任何物质都含有约6.02×1023个原子B.硫酸的摩尔质量是98gC.1mol N2的质量是28gD.摩尔是国际单...
- 平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐(含有结晶水),其中氢元素的质量分数为0.040.取该碱式盐...
- 在NaCl和Na2SO4的混合液中,当Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍时,下列叙述正确的是( )A.溶液中可能含有0.5m...
- 下列描述或应用中,正确的是( )A.常温常压下,28g N2和CO的混合气体体积约为22.4LB.一个钠原子的质量约为236.02×1023gC....
- 将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是...
- 在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积[ ]A.小于100mLB.等于...
- 将甲苯和甘油以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是( )A.40%B.35%C.30%D.无法计算
- 1mol CO和1mol CO2具有相同的:①分子数 ②原子总数 ③碳原子数 ④氧原子数( )A.①③B.②④C.①④D.①②③