本试题 “碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘...” 主要考查您对电解池原理
物质的除杂
离子的检验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解池原理
- 物质的除杂
- 离子的检验
电解池:
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


除杂的原则:
(1)不增:不增加新的杂质
(2)不减:被提纯的物质不能减少
(3)易分:操作简便,易于分离
气体除杂的原则:
(1)不引入新的杂质
(2)不减少被净化气体的量注意的问题:
①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:
A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开
B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去
C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可
D. 加热升华法:欲除去碘中的沙子,即可用此法
E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法
F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体
G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法
H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离
K. 渗析法:欲除去胶体中的离子,可采用此法。如除去氢氧化钠胶体中的氯离子
常见物质除杂总结:
原物所含杂质除杂质试剂除杂质的方法
(1)N2(O2)-------灼热的铜丝网洗气
(2)CO2(H2S)-------硫酸铜溶液洗气
(3)CO(CO2)-------石灰水或烧碱液洗气
(4)CO2(HCl)-------饱和小苏打溶液洗气
(5)H2S(HCl)-------饱和NaHS溶液洗气
(6)SO2(HCl)-------饱和NaHSO3溶液洗气
(7)Cl2(HCl)-------饱和NaCl溶液洗气
(8)CO2(SO2)-------饱和小苏打溶液洗气
(9)碳粉(MnO2)-------浓盐酸加热后过滤
(10)MnO2(碳粉)-------加热灼烧
(11)碳粉(CuO)-------盐酸或硫酸过滤
(12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体
(13)Fe2O3(Al2O3)-------NaOH溶液过滤
(14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体
(15)SiO2(ZnO)-------盐酸过滤
(16)CuO(ZnO)-------NaOH溶液过滤
(17)BaSO4(BaCO3)-------稀硫酸过滤
(18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤
(19)NaHCO3(Na2CO3)-------通入过量CO2
(20)Na2CO3(NaHCO3)-------加热
(21)NaCl(NaHCO3)-------盐酸蒸发结晶
(22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤
(23)FeCl3(FeCl2)-------通入过量Cl2
(24)FeCl3(CuCl2)-------铁粉、Cl2过滤
(25)FeCl2(FeCl3)-------铁粉过滤
(26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析
(27)CuS(FeS)-------稀盐酸或稀硫酸过滤
(28)I2(NaCl)------升华
(29)NaCl(NH4Cl)-------加热
(30)KNO3(NaCl)-------蒸馏水重结晶
(31)乙烯(SO2、H2O)碱石灰洗气
(32)乙烷(乙烯)-------溴水洗气
(33)溴苯(溴)-------稀NaOH溶液分液
(34)硝基苯(NO2)-------稀NaOH溶液分液
(35)甲苯(苯酚)-------NaOH溶液分液
(36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏
(37)乙醇(水)-------新制生石灰蒸馏
(38)苯酚(苯)-------NaOH溶液、CO2分液
(39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液
(40)溴乙烷(乙醇)-------蒸馏水分液
(41)肥皂(甘油)-------食盐过滤
(42)葡萄糖(淀粉)-------(半透膜)渗析
(1)不增:不增加新的杂质
(2)不减:被提纯的物质不能减少
(3)易分:操作简便,易于分离
气体除杂的原则:
(1)不引入新的杂质
(2)不减少被净化气体的量注意的问题:
①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。
方法:
A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开
B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去
C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可
D. 加热升华法:欲除去碘中的沙子,即可用此法
E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法
F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体
G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法
H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离
K. 渗析法:欲除去胶体中的离子,可采用此法。如除去氢氧化钠胶体中的氯离子
常见物质除杂总结:
原物所含杂质除杂质试剂除杂质的方法
(1)N2(O2)-------灼热的铜丝网洗气
(2)CO2(H2S)-------硫酸铜溶液洗气
(3)CO(CO2)-------石灰水或烧碱液洗气
(4)CO2(HCl)-------饱和小苏打溶液洗气
(5)H2S(HCl)-------饱和NaHS溶液洗气
(6)SO2(HCl)-------饱和NaHSO3溶液洗气
(7)Cl2(HCl)-------饱和NaCl溶液洗气
(8)CO2(SO2)-------饱和小苏打溶液洗气
(9)碳粉(MnO2)-------浓盐酸加热后过滤
(10)MnO2(碳粉)-------加热灼烧
(11)碳粉(CuO)-------盐酸或硫酸过滤
(12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体
(13)Fe2O3(Al2O3)-------NaOH溶液过滤
(14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体
(15)SiO2(ZnO)-------盐酸过滤
(16)CuO(ZnO)-------NaOH溶液过滤
(17)BaSO4(BaCO3)-------稀硫酸过滤
(18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤
(19)NaHCO3(Na2CO3)-------通入过量CO2
(20)Na2CO3(NaHCO3)-------加热
(21)NaCl(NaHCO3)-------盐酸蒸发结晶
(22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤
(23)FeCl3(FeCl2)-------通入过量Cl2
(24)FeCl3(CuCl2)-------铁粉、Cl2过滤
(25)FeCl2(FeCl3)-------铁粉过滤
(26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析
(27)CuS(FeS)-------稀盐酸或稀硫酸过滤
(28)I2(NaCl)------升华
(29)NaCl(NH4Cl)-------加热
(30)KNO3(NaCl)-------蒸馏水重结晶
(31)乙烯(SO2、H2O)碱石灰洗气
(32)乙烷(乙烯)-------溴水洗气
(33)溴苯(溴)-------稀NaOH溶液分液
(34)硝基苯(NO2)-------稀NaOH溶液分液
(35)甲苯(苯酚)-------NaOH溶液分液
(36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏
(37)乙醇(水)-------新制生石灰蒸馏
(38)苯酚(苯)-------NaOH溶液、CO2分液
(39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液
(40)溴乙烷(乙醇)-------蒸馏水分液
(41)肥皂(甘油)-------食盐过滤
(42)葡萄糖(淀粉)-------(半透膜)渗析
离子的检验:
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-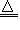 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O
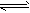 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH-
(4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2 CuO+H2O
CuO+H2O
(9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
(1)焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
(2)H+:H+酸性。遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
(3)NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;NH4++OH-
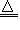 NH3↑+H2O;NH3+H2O
NH3↑+H2O;NH3+H2O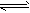 NH3?H2O
NH3?H2O NH4++OH-
NH4++OH- (4)Fe3+:①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[Fe(SCN)]2+;②通NaOH溶液红褐色沉淀:Fe3++3OH-==
Fe(OH)3↓
(5)Fe2+:①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:Fe3++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O==4Fe(OH)3;
②试液中加KSCN少量无明显变化再加氯水出现血红色: 2Fe2++Cl2==2Fe3++2Cl-;Fe3++SCN-==[Fe(SCN)]2+
(6)Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
(7)Al3+:遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;Al(OH)3+OH-==
AlO2-+2H2O
(8)Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2
 CuO+H2O
CuO+H2O (9)Ba2+:遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
(10)Ag+: ①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;2AgOH==Ag2O+H2O;AgOH+2NH3?H2O==[Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag++Cl-==AgCl↓
(11)OH-:OH-碱性:①遇紫色石蕊试液变蓝;②遇酚酞试液变红;③遇湿润红色石蕊试纸变蓝;
(12)Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
(13)Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
(14)I-: ①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
(15)S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
(16)SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
(17)SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑ SO2使品红溶液褪色
(18)CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O
(19)HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
(20)NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(21)PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
发现相似题
与“碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸...”考查相似的试题有:
- 用石墨电极电解CuCl2溶液(如图).下列分析正确的是( )A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应...
- (10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。(1)A极发生的电极反应...
- 将分别盛有100 mL的KCl溶液、NaNO3溶液、CuSO4溶液的三个电解槽(电极均为惰性电极)依次串联,通直流电进行电解,当某极析出...
- 科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法在阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O...
- 现有氯化钠样品(混有少量杂质离子:Mg2+、Ca2+、SO42-),某同学设计了以下实验方案对该样品进行提纯。(1)所加物质化学式A...
- 下列各组混合物中,用分液漏斗不能分离的是A.正己烷和水B.甲苯和水C.乙酸和乙醇D.溴苯和水
- (7分)现有失去标签的两瓶无色溶液:氯化钠溶液和稀盐酸。某化学探究小组打算用物理和化学两种方法加以区别。请回答:(1)...
- 为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强...
- (12分)对于混合物的分离或提纯,常采用的方法有:①过滤 ②蒸发结晶 ③蒸馏 ④萃取 ⑤洗气 。选用合适的方法序号填空。(1)从碘水...
- 下列鉴别苏打(Na2CO3)和小苏打(NaHCO3)的方法错误的是( )A.取两种样品溶液加入澄清石灰水,观察是否出现白色沉淀B.取固...