本试题 “关于物质的用途,下列说法不合理的是( )A.稀盐酸用于除铁锈B.碳酸氢钠用于制造发酵粉C.食盐可作防腐剂D.氢氧化钠固体用于干燥SO2” 主要考查您对一氧化碳还原氧化铜
氢气还原氧化铜
木炭还原氧化铜
盐的用途
离子的共存
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化碳还原氧化铜
- 氢气还原氧化铜
- 木炭还原氧化铜
- 盐的用途
- 离子的共存
氧化铜自身具有氧化性,我们可以用一氧化碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
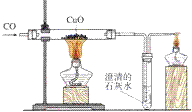
一氧化碳还原氧化铜的实验:
1. 实验器材
铁架台、酒精灯(也可以是酒精喷灯)、试管、导管、双孔橡皮塞、单孔橡皮塞。 药品有:氧化铜、澄清石灰水、一氧化碳
2. 化学反应
CO与CuO反应的化学方程式为: CO+ 2CuO
 2Cu + CO2
2Cu + CO2 CO2与Ca(OH)2(澄清石灰水)反应的化学方程式: Ca(OH)2+CO2=CaCO3↓+H2O
3. 反应现象
①黑色固体变成红色②导管口有气泡冒出③澄清石灰水变浑浊
4. 实验步骤
(1)连接装置
(2)检查装置的气密性。
(3)点燃加热尾气的酒精灯。
(4)通入CO,排除串联装置中的空气。
(5)加热CuO。
(6)停止加热CuO。
(7)通入CO,排净残留在串联装置中的空气。
(8)停止点燃尾气。
注:①先通入CO一会儿,是为了防止玻璃管内的空气没有排尽,加热时发生爆炸。
②继续通入CO到玻璃管冷却为止,是为了防止生成的铜重新被氧化为氧化铜、防止澄清石灰水倒流。
总之:"CO早出晚归,酒精灯迟到早退",也说“先通后点防爆炸,先熄后停防氧化。”
③用酒精灯点燃是进行尾气处理:防止一氧化碳污染空气,使人中毒。
注:此试验应在通风橱中进行:防止没除净的CO使人中毒。
5. 装置:
氧化铜自身具有氧化性,我们可以用氢气还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
氢气还原氧化铜实验:
| 原理 | H2+CuO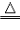 H2O+Cu H2O+Cu |
| 装置 |  |
| 步骤 | ①先通氢气(直到盛氧化铜的试管内充满纯净的氢气) ②后点燃洒精灯加热 ③先熄灭洒精灯停止加热(当出现明显的实验现象后) ④后停止通氢气(等试管冷却后再停止) 简单记忆为“氢气早来晚走,酒精灯迟到早退” |
| 现象 | ①黑色氧化铜变成光亮红色 ②试管口处有小水珠 |
| 注意事项 | ①通氢气的导管必须伸入试管底部,保证与氧化铜充分反应 ②必须先通氢气后加热,否则可能会发生爆炸 ③停止加热后必须等试竹冷却后再停止通氢气,否则铜可能会重新被氧化 |
实验总结顺口溜:
氢气验纯试管倾
先通氢气后点灯
黑色变红水珠出
熄灭灯后再停氢
氧化铜自身具有氧化性,我们可以用碳还原氧化铜。
灼热的氧化铜可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铜+X(氧化物)。
木炭还原氧化铜实验:
1.原理:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
2.装置: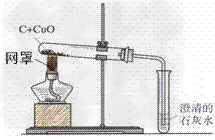
3.现象:
①黑色粉末变成红色;
②澄清石灰水变浑浊
4.步骤:①装药品;②固定试管,连接装置;③加热;④撤出导管;⑤熄灭酒精灯
5.注意:
①要先撤导管再扯酒精灯,防止水倒吸。
②要充分加热木炭和氧化铜粉末,除去其中水分。
③研磨混合要充分。
④加热温度要足够,最好使用酒精喷灯或煤气灯
常见盐的用途:
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
概念:
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S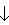 +3H2O反应不能共在。
+3H2O反应不能共在。
③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
判断离子是否共存的方法:
复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和 CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:
①由于发生复分解反应,离子不能大量共存。
A.有气体产生。如CO32- 、SO32- 、S2- 、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。如Ba2+ 、Ca2+ 、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,
但在酸性条件下则由于发生2S2- +SO32- +6H+=3S
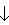 +3H2O反应不能共在。
+3H2O反应不能共在。③溶液中能发生络合反应的离子不能大量共存。
如Fe2+ 、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
①酸性溶液(H+)、碱性溶液(OH-)等不能共存的离子。
②溶液的颜色:有色离子
MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)等
发现相似题
与“关于物质的用途,下列说法不合理的是( )A.稀盐酸用于除铁...”考查相似的试题有:
- 做氢气还原氧化铜的实验时,先通氢片刻后再加热氧化铜;停止反应时,先停止通氢再 熄灭酒精灯,结果实验失败了,是因为发生了...
- 规范操作是实验成功的保证.下列操作正确的是( )A.熄灭酒精灯用嘴吹灭B.木炭还原氧化铜的实验结束时,先熄灭酒精灯C.实...
- 下列离子能在pH=13的水溶液中大量共存的是A.K+、SO42﹣、NH4+B.K+、Cu2+、NO3﹣C.Cl﹣、Na+、CO32﹣D.Ba2+、SO42﹣、Na+
- (5分)根据要求回答下列问题:棉花生长 改良酸性土壤(1)棉花的主要成分是 。(2)棉花茎叶生长迟缓,叶片发黄,并出现倒伏...
- 小玲同学对所学部分化学知识归纳如下,其中有错误的一组是[ ]A. 物质的性质和用途:N2性质稳定--填充食品袋乙醇具有可燃性--...
- 高中教材中有这样一个实验:在两支同样大小的试管中分别加入3mL(足量)稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气...
- 列举3种生活、生产中常见的盐,写出其主要成分的化学式,并简要写出该物质在生产、生活中的某种用途.序 号物 质化 学 式用 ...
- 在pH=1的溶液中,含有大量的Cl-、SO42-、K+,则溶液中还可能存在的大量离子有①CO32-②NO3-③Na+④Ba2+⑤OH-( )A.②③⑤B.①②③C.②...
- 将下列物质长期露置于空气中,质量增加的是( )A.氧化钙B.氢氧化钠C.浓盐酸D.浓硝酸
- 某溶液中含有AgNO3、Cu(NO3)2、Ba(NO3)2三种溶质,用①NaCl ②Na2CO3③Na2SO4溶液分别将溶液中的Ag+、Cu2+、Ba2+离子沉淀出...