本试题 “通过如图所示实验可以得出的结论,其中不合理的是[ ]A.甲实验既可探究可燃物的燃烧条件,又可以说明白磷的着火点比红磷低,也由此可推出灭火的方法B.乙实验...” 主要考查您对一氧化碳还原氧化铁
二氧化碳的性质实验
验证物质燃烧的条件
验证分子特点的实验
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化碳还原氧化铁
- 二氧化碳的性质实验
- 验证物质燃烧的条件
- 验证分子特点的实验
氧化铁自身具有氧化性,我们可以用一氧化碳还原氧化铁。
灼热的氧化铁可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铁+X(氧化物)。
实验室一氧化碳还原氧化铁:
①反应原理:3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 ②装置:
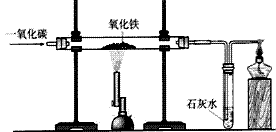
③现象:红色粉末逐渐变为黑色;澄清石灰石变浑浊,尾气燃烧时产生蓝色火焰。
④实验步骤:
a.检验装置的气密性
b.装入药品并固定装置
c.通入一氧化碳气体并点燃酒精灯
d.待装置内的空气全部排尽后点燃酒精喷灯给氧化铁加热
e.当试管内的红色粉末变为黑色时,停止加热
f.待玻璃管内的固体冷却后,停止通一氧化碳,并熄灭酒精灯
⑤实验结论:红色的氧化铁被一氧化碳还原成单质铁,一氧化碳在高温条件下得到了氧,生成了二氧化碳。
⑥化学反应方程式:
3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 CO2+Ca(OH)2==CaCO3↓+H2O
2CO+O2
 2CO2
2CO2⑦注意事项:
a.反应条件:高温;若无洒粉喷灯可在酒精灯火焰上加一个金属网罩。
b.CO有剧毒,实验应在通风橱中进行,未反应完的气体要进行尾气处理;尾气处理方法有收集法、燃烧法(将CO转变为无毒的CO2)以防止污染空气。
c.操作顺序:CO要“早出晚归”,洒精喷灯要“迟到早退”。
实验开始先通入CO,排尽装置内的空气,防止CO 与空气混合,加热时发生爆炸;实验完毕后要继续通入 CO气体,直到玻璃管冷却,防止高温下的铁与空气接触,被氧化。
探究二氧化碳的三个性质实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
3.二氧化碳能溶于水
二氧化碳性质探究实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
(1)装置: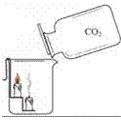
(2)现象:蜡烛由低到高依次熄灭
结论:证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
(1)装置:
(2)现象:1和4实验中的白花变红,2和3白花不变色
(3)结论:二氧化碳不能使紫色石蕊试液变红,二氧化碳的水溶液能使紫色石蕊试液变红。
(或二氧化碳溶于水显酸性)
3.二氧化碳能溶于水
(1)装置: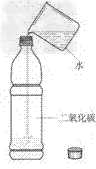
(2)现象:塑料瓶变瘪
(3)结论:二氧化碳能溶于水。
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
3.二氧化碳能溶于水
二氧化碳性质探究实验:
1.证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
(1)装置:

(2)现象:蜡烛由低到高依次熄灭
结论:证明二氧化碳的密度比空气的大;二氧化碳既不燃烧也不支持燃烧
2.二氧化碳溶于水显酸性
(1)装置:

(2)现象:1和4实验中的白花变红,2和3白花不变色
(3)结论:二氧化碳不能使紫色石蕊试液变红,二氧化碳的水溶液能使紫色石蕊试液变红。
(或二氧化碳溶于水显酸性)
3.二氧化碳能溶于水
(1)装置:

(2)现象:塑料瓶变瘪
(3)结论:二氧化碳能溶于水。
定义:
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
2. 探究燃烧条件的实验设计方法
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量
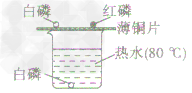
①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
燃烧是一种发光、发热的剧烈的化学反应。认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
燃烧条件的探究实验:
1. 实验方案
| 实验方案 | 实验现象 | 分析 |
分别将一小块白磷和一小块红磷放在薄铜片上,另取一小块白磷放入热水中,如下图: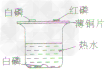 |
①薄铜片上:白磷燃烧,产生大量白烟,红磷没有变化 ②热水中,白磷没有燃烧 |
①白磷、红磷都是可燃物.薄铜片上的白磷与O2接触,同时温度达到白磷的着火点,故白磷能够燃烧 ②薄铜片上的红磷与O2 接触,但温度没有达到其着火点,热水中的白磷温度达到了其着火点.但没有与O2接触,所以红磷和水中的白磷都不能燃烧 |
2. 实验结论:
燃烧必须同时具备:
①可燃物
②氧气(空气)
③达到燃烧所需的最低温度(着火点)
1. 着火点:可燃物燃烧所需的最低温度叫着火点,是物质固有的一种性质,与物质本身的性质有关,一般不随外界条件的改变而改变。
在通常状况下一些常见物质的着火点
| 物质 | 白磷 | 红磷 | 木材 | 木炭 | 无烟煤 |
| 着火点/℃ | 40 | 240 | 250-330 | 320-370 | 700-750 |
燃烧必须同时具备: ①可燃物 ②氧气(空气) ③达到燃烧所需的最低温度(着火点)。中考试题往往以实验设计题的形式来考查燃烧规律。燃烧条件的探究设计常常运用控制变量—对比法。
(1)分析对比实验设计

实验1:探究可燃物才能燃烧
实验2:探究可燃物接触氧气才能燃烧
实验3:探究达到着火点可燃物才能燃烧
(2)综合控制变量

①把白磷和红磷都漏置在空气中(对比),用0℃的热水控制温度(这个温度高于白磷的着火点,低于红磷的着火点),白磷能燃烧,红磷不能燃烧,证明可燃物与氧气接触,且可燃物还必须达到着火点才能燃烧。
②烧杯底部放一块白磷,用水控制不让白磷与空气接触,温度仍然是80℃,与铜片上的白磷对比,证明可燃物即使温度达到着火点,如果不与氧气接触也不能燃烧。
验证分子特点的实验:
通过对分子特点的探究,可以让学生直观的感受到微观世界里分子构成物质的特点。
探究分子运动的实验:
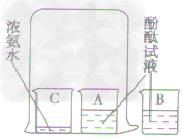
| 实验装置 |
| ||
| 实验步骤 | 步骤1 | 步骤2 | 步骤3 |
| 在盛有约40ml 蒸馏水的烧杯中加 如5一6滴酚酞试液,搅拌均匀, 观察现象 |
取步骤I得到的溶液,置于 试管中,再向其中滴加浓 氨水,观察现象 |
将烧杯中的溶液分别倒入 A、B两个小烧杯中,另取 一个小烧杯C,加入约5ml 浓 氨水。用一个大烧杯罩住 A,C两个小烧杯,烧杯B 置于大烧杯外 | |
| 实验现象 | 无明显现象 | 溶液由无色变成红色 | 烧杯A中液体由无色变为红色,烧杯B中无变化 |
| 实验解释 | 烧杯中的浓氨水挥发出氛分子,氨分了进人烧杯A中,使溶液变成红色.而烧杯B中没有氨分子进入 | ||
探究分子间有间隙的实验:
| 实验原理 | 分子之间存在间隙且分子总是做不停地无规则运动。将水和酒精充满容量瓶,混合均匀后,若液面发生下降,则可验证分子间存在间隙。 | ||
| 实验用品 | 100ml 容量瓶 1 只、 100ml 烧杯 2 只、餐纸、保鲜膜、棉线一根、无水酒精、 纯净水、品红溶液。 | ||
| 实验装置 | 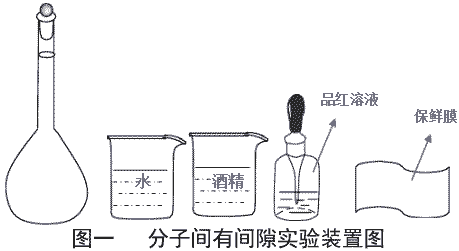 | ||
| 实验步骤 | 实验结果 | 实验结论 | |
| 实验方案一 | (1) 打开容量瓶,用小烧杯移取 70ml 已滴加了品红溶液的水于容量瓶中。 (2) 用小烧杯移取酒精于容量瓶中直至容量瓶满。 (3) 塞上容量瓶塞,有液体溢出,用餐纸擦干。倒置容量瓶几次,使液体充分混 合,观察液面下降情况。 |
液面下降 1.5cm 左右,实验现象非常明显 | 优点: (1) 酒精用量少,该实验只需耗费 30ml 左右的酒精 (2) 滴入品红溶液的水呈红色,可明显观察到在容量瓶倒置前,容量瓶中液体分 层,上层无色,下层红色。而倒置后溶液呈均匀红色。 (3) 倒置前容量瓶充满液体,排除了会有部分液体残留在容量瓶上导致的误差。 (4) 实验现象明显,混合后液面下降 1.5cm 左右 (5) 实验操作简单,实验用品少 缺点:将充满的容量瓶塞上容量瓶塞会有液体溢出,这个操作不规范。 |
| 实验方案二 | (1) 打开容量瓶,用小烧杯移取 70ml 已滴加了品红溶液的水于容量瓶中。 (2) 用小烧杯移取酒精于容量瓶中直至容量瓶满。 (3) 用保鲜膜迅速包裹容量瓶,然后将保鲜膜用细线捆紧。用手掌压住容量瓶口, 倒置容量瓶几次,使液体充分混合,观察液面下降情况。 |
液面下降 1cm 左右,实验现象非常明显。用无水硫酸铜检验容量瓶外壁, 并无液体溢出。 | 优点: (1) 酒精用量少,该实验只需耗费 30ml 左右的酒精 (2) 滴入品红溶液的水呈红色,可明显观察到在容量瓶倒置前,容量瓶中液体分 层,上层无色,下层红色。而倒置后溶液呈均匀红色。 (3) 倒置前容量瓶充满液体,排除了会有部分液体残留在容量瓶上导致的误差。 (4) 实验现象明显,混合后液面下降 1cm 左右 (5) 实验操作简单,实验用品少 (6) 方案二很好的解决了方案一的缺陷,且实验效果好。 |
发现相似题
与“通过如图所示实验可以得出的结论,其中不合理的是[ ]A.甲实...”考查相似的试题有:
- (7分)冬天,小方陪妈妈去医院打点滴,发现护士往输液管上放了一个纸包(如图所示),经询问得知它可以温暖输入人体中的液体...
- 将过量的铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,充分反应后,过滤。下列对滤液所含溶质的说明中,正确的是A.只有Fe(NO3)2B...
- (10分)(2012•宁夏)某学习小组的同学在做碳酸钠溶液和澄清石灰水反应的实验后,将反应后的浑浊液进行过滤,得到澄清的滤液...
- 1.实验室用高锰酸钾制取氧气,放一团棉花在靠近试管口的地方,目的是_____________,停止加热时,要先把导管移出水面,后熄...
- 要除去硫酸锌溶液中混有的少量硫酸和硫酸铜,可加入下列物质中的A.氢氧化钠B.锌粉C.氧化锌D.镁粉
- (1)如图1装置可对“可燃物燃烧的条件”进行探究.图2是某小组的改进装置,这样改进的优点是______;改进试验中试管中白磷燃烧...
- 用下图所示装置探究燃烧的条件。下列说法正确的是A.试管中的红磷不燃烧,说明红磷的着火点大于60oCB.水中的白磷不燃烧,说...
- 如下图所示,将滴有酚酞试液的滤纸条放在试管里,将试管置于实验台上。(1)用仪器A吸取浓氨水,滴在管口棉花上(10-15滴),A的...
- 对下列现象的微观解释中,不正确的是A.用搜救犬搜救地震中被埋在废墟下的幸存者分子在不断地运动B.用水银温度计测量体温温...
- 对水的沸腾现象解释合理的是( )A.水分子体积增大B.水分子本身发生变化C.水分子质量减轻D.水分子间隔发生变化