本试题 “下列有关氧气的叙述正确的是[ ]A .氧气能和大多数金属、有机物反应,所以氧气是一种很不稳定的气体B .铁在氧气中燃烧生成氧化铁C .给氯酸钾加热,若不加二...” 主要考查您对空气中氧气含量的测定
氧气的性质
催化剂和催化作用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 空气中氧气含量的测定
- 氧气的性质
- 催化剂和催化作用
空气中氧气含量的测定实验是初中化学的一个重要实验,同时也是历年各地中考命题的热点。近年来在课本实验的基础上进行拓展、创新,旨在考查同学们的实验探究能力及创新思维能力已成为中考命题的趋势。
空气中氧气含量的测定实验:
| 原理 | 利用红磷在空气中燃烧,将瓶内氧气消耗掉,生成五氧化二磷固体,使空气内压强减少,在大气压作用下,进入容器内水的体积即为减少的氧气的体积。4P + 5O2 2P2O5 2P2O5 |
| 装置 | 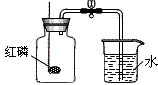 |
| 步骤 | ①连接装置,检查装置气密性 ②把集气瓶的容积分成5等份,做好记号。 ③用止水夹夹紧胶管。 ④在燃烧匙内放入过量的红磷。 ⑤点燃燃烧匙中的红磷,立即伸入集气瓶中,把塞子塞紧 ⑥待红磷熄灭并冷却后,打开止水阀 |
| 现象 | ①集气瓶中有大量的白烟生成,并放出热量 ②打开止水夹,烧杯中的水倒流到集气瓶中,并上升到约1/5处 |
| 结论 | 空气中氧气的体积分数约为1/5。 |
实验中的注意事项:
1.测定空气中氧气的体积分数时,所用物质应满足的条件:
①此物质能够在空气中中燃烧,不能用铁丝代替,铁丝在空气中不能燃烧
②此物质在空气中燃烧的时只能消耗氧气,不能消耗其他气体。不能选用镁代替红磷,因为镁不仅与空气中的氧气反应,还和二氧化碳反应。
③此物质在空气中燃烧时只能生成固体,而不能生成气体,一般不用木炭,硫代替红磷。
2.实验失败与成功的原因:
①装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
②实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
③实验完毕,待容器冷却至室温后,再打开止水夹,观察进水的体积,避免因温度高,气体膨胀,使测定结果低于1/5.
空气中氧气含量测定实验的改进:
1.测定原理:
(1)红磷(白磷)在密闭的容器中燃烧,消耗氧气,生成白色固体五氧化二磷。密闭容器内压强减小,大气压将水压入容器,通过测定容器中的水的量测定氧气在空气中的含量。
(2)利用金属与氧气反应,消耗密闭容器中的氧气使密闭容器内压强减小,在大气压的作用下,推动刻度器上的活塞移动,测出氧气体积。
2.装置
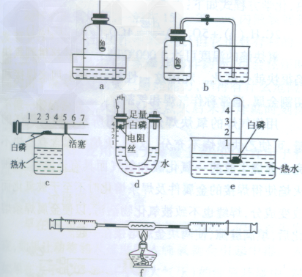
3.实验现象
(1)红磷(白磷)燃烧,产生大量白烟
(2)a中睡眠上升约占钟罩内空气体积的1/5
b中进入集气瓶中水的体积约占集气瓶液面以上容积的1/5
c中活塞移动到4处
d中U形管左侧液面上升至刻度1处
e中试管中液面上升至刻度1处
f中右侧的活塞会左移
4.结论
空气中氧气体积约占空气总体积的1/5
5.注意事项
(1)实验中红磷要过量,以消耗容器内全部氧气,否则会使测定结果低于1/5.
(2)装置不漏气是本实验成功的关键,所以实验前应检查装置的气密性。如果气密性不好,外界空气会进入容器,使测定结果低于1/5。
(3)不能用硫、木炭、铁丝等代替红磷(白磷)。因为硫或木炭燃烧后产生的气体会弥补反应所消耗的氧气,导致测得的体积不准确,而细铁丝在空气中难以燃烧,氧气体积几乎不变,因此密闭空气内水面不上升。
(4)导气管要夹紧,燃烧匙放入集气瓶时要迅速,防止空气受热膨胀,从导气管或集气瓶逸出,导致进入水的体积增多,使实验结果偏高。
定义:
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体) 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)
(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2 2MgO
2MgO
3Fe+2O2 Fe3O4
Fe3O4
②与非金属的反应:
C+O2 CO2(O2充分)
CO2(O2充分)
2C+O2 2CO(O2不充分)
2CO(O2不充分)
③与化合物的反应:
2CO+O2 2CO2
2CO2
CH4+2O2 CO2+2H2O
CO2+2H2O
C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
氧气,空气主要组分之一,比空气重,标准状况(0℃和大气压强101325帕)下密度为1.429克/升。无色、无臭、无味。在水中溶解度很小。压强为101kPa时,氧气在约-183摄氏度时变为淡蓝色液体,在约-218摄氏度时变成雪花状的淡蓝色固体。
氧气的性质:
1.氧气的物理性质:
(1)无色无味,标况下,氧气的密度为1.429g/L,密度比空气大,难溶于水,1L水中只能溶解约30ml的氧气。
(2)三态变化:氧气(无色气体)
 液氮(淡蓝色液体)
液氮(淡蓝色液体) 固态氮(淡蓝色雪花状)
固态氮(淡蓝色雪花状)(3)工业产生的氧气,一般加压贮存在蓝色的钢瓶中。
2.氧气的化学性质:
(1)化学性质较活泼,在一定条件下,可以和多种物质发生化学反应,同时放出热量;具有助燃性和氧化性,在化学反应中提供氧,是一种常用的氧化剂。
(2)助燃性,氧化性
①与金属的反应:
2Mg+O2
 2MgO
2MgO3Fe+2O2
 Fe3O4
Fe3O4②与非金属的反应:
C+O2
 CO2(O2充分)
CO2(O2充分)2C+O2
 2CO(O2不充分)
2CO(O2不充分)③与化合物的反应:
2CO+O2
 2CO2
2CO2CH4+2O2
 CO2+2H2O
CO2+2H2OC2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O易错点:
(1)误认为氧气具有可燃性,可以做燃料
氧气可以帮助可燃物燃烧,具有助燃性,它本身不能燃烧,不能做可燃物。
(2)误认为氧气的化学性质非常活泼,能与所有物质发生反应
氧气是一种化学性质非常活泼的气体,在一定条件下能与许多物质发生化学反应,但不是与所有物质都能发生化学反应。
(3)误认为燃烧都需要氧气
燃烧有广义和狭义之分,通常所说的燃烧是指可燃物与氧气发生的一种发光,放热的剧烈的氧化反应。燃烧的条件之一是需要氧气。但有一些燃烧不需要氧气,如镁在二氧化碳中也能燃烧。
(4)误认为物质与氧气的反应叫氧化反应
氧化反应是物质与氧发生的反应,其中包括物质与氧气中的氧元素发生的反应,也包括物质与其他含氧物质中的氧元素发生的反应。如氢气与氧气反应生成水是氧化反应,氢气与氧化铜反应生成铜和水也是氧化反应。
(5)误认为氧气与液氧性质不行
物质的性质包括物理性质和化学性质,氧气与液氧物理性质不同,但化学性质是相同的,因为它们二者的分子构成相同,都是由氧分子构成的。
(6)误认为含氧的物质都能制取氧气。
制取氧气需要含氧的物质,但不是所有的含氧物质都能用来制取氧气。
催化剂及催化作用的概念:
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
| 概念 | |
| 催化剂 | 在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。 |
| 催化作用 | 催化剂在化学反应中所起的作用 |
催化剂的特点:
催化剂概念的要点可概括为“一变”“二不变”。
(1)“一变”是指催化剂能改变其他物质的化学反应速率,这里“改变”包括加快和减慢,也就是说催化剂可以加快反应速率,也可以减慢反应速率。
(2)“二不变”指催化剂本身的化学性质不变。
易错点:
①催化剂一般有选择性,即仅能对某一反应或某一类型的反应起催化作用。如二氧化锰是过氧化氢分解的催化剂,但对其他的反应不一定是。
②对某些反应来说,催化剂也可能不止一种,如能催化过氧化氢分解的催化剂除二氧化锰外,还有硫酸铜溶液、红砖粉(主要成分为氧化铁)等。
③催化剂可以重复使用。
催化剂在化工生产中的作用:
催化剂在化工生产中有重要作用,人多数化工生产都有催化剂参与。例如,在石油炼制过程中,用高效催化剂生产汽油、煤油等;在汽车尾气处理,归用催化剂促进有害气体的转化;酿造工业和制药工业都要用酶作催化剂,某些酶制剂还是宝贵的药物。
发现相似题
与“下列有关氧气的叙述正确的是[ ]A .氧气能和大多数金属、有机...”考查相似的试题有:
- 某研究性学习小组设计了如图所示的定量测定装置,其中B是圆筒状玻璃容器(带密封盖子),上面标有以厘米为单位的刻度,其他夹...
- 已知空气的主要成分是氮气和氧气,某课外活动小组设计测定空气中氧气含量的实验,实验装置如下图所示:⑴红磷燃烧时的现象____...
- 右图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列说法中不正确的是( )A.该实验证...
- 实验是进行科学探究的重要手段。请根据图示回答:(1)图A中的错误是_____________________。(2)若用图B装置除去CO2中混有...
- 在水、二氧化碳和氧气三种物质中,其中一种物质具有的某种性质(特性),是其它两种物质所不具有的.例如:常温下水是液体,...
- 为防止实验室意外事故的发生,下列预处理方法中错误的是( )选项须预防的意外事故预处理方法A少量浓硫酸溅到皮肤上备氢氧化...
- 在O2、CO2、CO三种气体中,能支持燃烧的气体是 ;能在空气中燃烧的是 ,燃烧的化学方程式 ;能溶于水,其水溶液可使紫色的石...
- 将下列各种词语填在与之相符的空格中:乳化,氧化,催化,结晶(1)金属制品在空气中大多易与氧气发生化学反应,这种变化称为...
- 一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳.对此反应,下列叙述中正确的是( )A...
- 加热氯酸钾制氧气时,如果忘了加二氧化锰,其后果是( )A.氯酸钾不发生分解反应B.反应的速率很慢C.产生氧气的质量比加二...