本试题 “通过学习,我们知道了常见气体的实验室制取方法和相关性质,我能根据所学知识回答下列问题:(1)图1是实验室常用的制取气体的装置: 实验室用高锰酸钾制取氧...” 主要考查您对氧气的制取和收集
一氧化碳还原氧化铁
S,Fe,C,P等物质在氧气中的燃烧
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧气的制取和收集
- 一氧化碳还原氧化铁
- S,Fe,C,P等物质在氧气中的燃烧
氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 | |
| 药品和反应原理 | 2H2O2 2H2O+O2↑ 2H2O+O2↑ |
2KMnO4 K2MnO4 + MnO2 + O2↑ K2MnO4 + MnO2 + O2↑ |
| 发生装置 | 固液常温型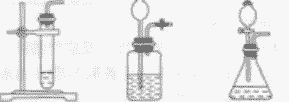 |
固体加热型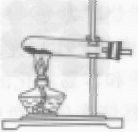 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集 | |
| 整体装置图 |  |
 |
| 操作步骤 | ①检查装置气密性 ②再锥形瓶中装入二氧化锰 ③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来) ④向长颈漏斗中加入过氧化氢溶液 ⑤收集氧气 |
①检查装置气密性 ②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花) ③将试管固定在铁架台上 ④点燃酒精灯,预热后加热试管 ⑤当导管口有连续均匀的气泡冒出时开始收集气体 ⑥收集完毕,先将导管移出水面 ⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。 ②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。 ③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。 ④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 |
①药品要平铺在试管底部,均匀受热。 ②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。 ③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。 ④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。 ⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。 ⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。 ⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。 ⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。 ⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。 ⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
氧化铁自身具有氧化性,我们可以用一氧化碳还原氧化铁。
灼热的氧化铁可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铁+X(氧化物)。
实验室一氧化碳还原氧化铁:
①反应原理:3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 ②装置:
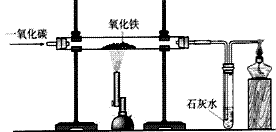
③现象:红色粉末逐渐变为黑色;澄清石灰石变浑浊,尾气燃烧时产生蓝色火焰。
④实验步骤:
a.检验装置的气密性
b.装入药品并固定装置
c.通入一氧化碳气体并点燃酒精灯
d.待装置内的空气全部排尽后点燃酒精喷灯给氧化铁加热
e.当试管内的红色粉末变为黑色时,停止加热
f.待玻璃管内的固体冷却后,停止通一氧化碳,并熄灭酒精灯
⑤实验结论:红色的氧化铁被一氧化碳还原成单质铁,一氧化碳在高温条件下得到了氧,生成了二氧化碳。
⑥化学反应方程式:
3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 CO2+Ca(OH)2==CaCO3↓+H2O
2CO+O2
 2CO2
2CO2⑦注意事项:
a.反应条件:高温;若无洒粉喷灯可在酒精灯火焰上加一个金属网罩。
b.CO有剧毒,实验应在通风橱中进行,未反应完的气体要进行尾气处理;尾气处理方法有收集法、燃烧法(将CO转变为无毒的CO2)以防止污染空气。
c.操作顺序:CO要“早出晚归”,洒精喷灯要“迟到早退”。
实验开始先通入CO,排尽装置内的空气,防止CO 与空气混合,加热时发生爆炸;实验完毕后要继续通入 CO气体,直到玻璃管冷却,防止高温下的铁与空气接触,被氧化。
氧化的化学性质很活泼,很多物质都能与氧气发生化学反应。
部分物质在空气中和氧气中反应的对比:
a)碳和氧气反应
方程式:C + O2 CO2
CO2
现象:剧烈燃烧,发白光,放热,生成使澄清石灰水变浑浊的气体
b)硫和氧气反应
方程式:S + O2 SO2
SO2
现象:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
注意:实验前应在瓶底放少量水,用来吸收生成的有毒气体。
c)红磷和氧气反应:
方程式:4P + 5O2 2P2O5
2P2O5
现象:发出耀眼的白光,放热,生成大量白烟
生成的P2O5是固体小颗粒,现象为白烟,不是白雾。
d)铁和氧气的反应:
方程式:3Fe + 2O2 Fe3O4
Fe3O4
现象:剧烈燃烧,火星四射,放出热量,生成黑色物质
注意:集气瓶底放一层细沙或少量水。
e)镁和氧气反应:
方程式:2Mg + O2 2MgO
2MgO
现象:剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体,有白烟。
注意:不能手持镁条,应用坩埚钳夹持。
f)石蜡和氧气反应
文字表达式:石蜡+氧气 水+二氧化碳
水+二氧化碳
现象:剧烈燃烧,放出热量,发出白光,如果在火焰上方罩一个干冷烧杯,
烧杯内壁有水珠,生成使澄清石灰水变浑浊的气体。
烟和雾的区别:
a)烟:大量固体小颗粒分散在空气长产生烟。红磷燃烧产生大量白烟,是燃烧生成的固体P2O5分散在空气中形成的
b)雾:大量小液滴分散在气体中产生雾。打开盛浓盐酸的瓶塞,瓶口有白雾,是挥发的HCl气体遇到空气中的水蒸气形成了盐酸小液滴。
a)光:固体物质燃烧使发光。镁条燃烧发出耀眼的强光,木炭在氧气中燃烧产生白光
b)气体物质和容易气化的物质燃烧时产生火焰。蜡烛在氧气中燃烧产生白色的火焰,是石蜡熔化后生成的气体燃烧而产生的。
描述物质在氧气中燃烧的现象的技巧:
可按三个顺序从三个方面进行:
(1)剧烈燃烧,有什么颜色的光,火焰;
(2)放热;
(3)生成物的特性
与“通过学习,我们知道了常见气体的实验室制取方法和相关性质,...”考查相似的试题有:
- 下列实验现象描述正确的是A.镁条在氧气中燃烧,生成黑色固体B.米汤中加入碘酒,呈现蓝色C.把银片浸入硫酸铜溶液一段时间后...
- (13分)根据实验装置图,回答下列问题:(1)写出A中三种仪器的名称:① 、② 、③ 。(2)实验室若用排空气法收集氧气可选用① ...
- 通过一年的化学学习,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。(1)写出图中标示的仪器名称:① ...
- 有关实验操作,不能达到预期目的是( )A.用10mL量筒量取8.2mL水B.用电子天平称取5.6g氧化铜粉末C.用排水集气法可得到比较...
- 通过化学学习,应该知道有多种途径可以制取氧气.如:A、电解水;B、分离空气;C、加热高锰酸钾;D、分解过氧化氢;E、______...
- 下列实验操作、现象与结论对应关系正确的是选项实验操作现象结论A向氢氧化钠固体中加入水有热量放出氢氧化钠与水发生了化学反...
- 下列四个图象能正确反映其对应实验操作的是A.加热一定质量的碳酸氢钠B.用等质量、等质量分数的双氧水制取氧气C.向一定体积...
- 我们知道常见气体的实验室制取方法和相关性质,请根据所学知识回答下列问题:(1)实验室制取气体所需装置如下图所示。①实验...
- 某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢。他们用此装置,选择了甲、乙、丙、丁四种...
- 甲乙丙是三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:(1)所发生的三个反...