本试题 “氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示请回答下列问题:(1)由B2O3制备BF3、BN的化学方程...” 主要考查您对电负性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电负性
电负性:
(1)键合电子、电负性的定义
元素相互化合时,原子中用于形成化学键的电子称为键合电子。电负性用来描述不同元素的原子对键合电子吸引力的大小。
(2)电负性的意义:电负性越大的原子,对键合电子的吸引力越大。
(3)电负性大小的标准:以氟的电负性为4.0作为相对标准。
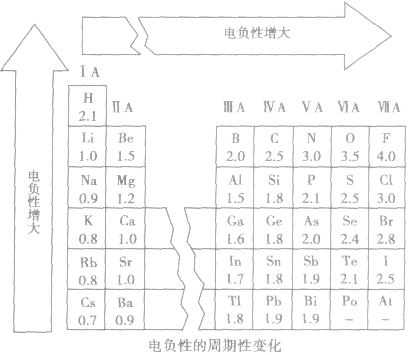
(4)电负性的变化规律
①随原子序数的递增,元素的电负性呈周期性变化。
②同周期,从左到右,元素的电负性逐渐变大。
③同主族,从上到下,元素的电负性逐渐变小。
电负性的应用:
①判断元素的金属性和非金属性的强弱
金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。
②判断元素化合价的正负
利用电负性可以判断化合物中元素化合价的正负:电负性大的元素易呈现负价,电负性小的元素易呈现正价。
③判断化学键的类型
一般认为,如果成键原子所属元素的电负性差值大于 1.7,它们之间通常形成离子键;如果成键原子所属元素的电负性差值小于1.7,它们之间通常形成共价键。
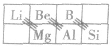
④解释“对角线规则”
在元素周期表中,某些主族元素与其右下方的主族元素(如右图所示)的有些性质是相似的,被称为“对角线规则”。例如:硼和硅的含氧酸盐都能形成玻璃且互熔,含氧酸都是弱酸等。
发现相似题
与“氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物...”考查相似的试题有:
- 下列说法中错误的是[ ]A.SO2、SO3都是极性分子B.在NH4+和[Cu(NH3)4]2+中都存在配位键C.元素电负性越大的原子,吸引电子的...
- 2010年上海世博会场馆,大量的照明材 料或屏幕都使用了发光二极管( LED)。 目前市售LED品片,材质基本以GaAs (砷化镓)、AlG...
- 电负性的大小也可以作为判断金属性和非金属性强弱的量度。下列关于电负性的变化规律正确的是[ ]A.周期表从左到右,元素的电...
- 下列各选项所述的两个量,前者一定大于后者的是( )①Al原子和N原子的未成对电子数②Ag+、Cu2+与NH3形成配合物时的配位数③NaCl...
- (1)中国古代四大发明之——黑火药,它的爆炸反应为2KNO3+ S + 3C == K2S + 3CO2↑ + N2↑ (已配平)①除S外,上列元素的电负性...
- (三选一)【选修3:物质结构与性质】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3...
- 下列说法正确的是( )A.磷原子的核外电子排布一定为[Ne]3s23p3B.基态原子变成激发态原子会释放出能量C.卤族元素的电负性...
- 下列说法中错误的是[ ]A.SO2和SO3都是极性分子B.NH4+和H3O+中都存在配位键C.元素电负性越大的原子,吸引电子的能力越强D....
- 下列不是元素电负性的应用的是[ ]A.判断一种元素是金属元素还是非金属元素B.判断化合物中元素化合价的正负C.判断化学键类...
- T、X、Y、Z、Q、R、W为周期表前四周期的元素,原子序数依次递增。已知:①W的原子序数为29,其余元素均为短周期主族元素;②T原...