本试题 “如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可...” 主要考查您对氯气
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯气
氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: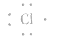
④氯的原子结构示意图: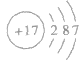
⑤氯原子的外围电子排布式:
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
氯气的物理性质和化学性质:
(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl2
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。 ②与非金属的反应 H2+Cl2
 2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。 ③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3 Cl2+SO2+2H2O==2HCl+H2SO4
⑤有机反应(参与有机反应的取代和加成反应)
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
Cl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)
⑥与水反应 Cl2+H2O
 HCl+HClO
HCl+HClO 发现相似题
与“如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲...”考查相似的试题有:
- (6分)在KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑ + 3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数...
- 下列叙述正确的是[ ]A. Cl2的水溶液可以导电,说明Cl2是电解质B. 在高温条件下,C能与SiO2发生置换反应,说明C的氧化性强于Si...
- 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全...
- 向红色溶液X中通入气体Y,溶液逐渐褪色,下列对X、Y的推断正确的是[ ]A.若X为品红溶液,则Y一定为Cl2或SO2B.若X为含酚酞的...
- 下列物质中,不能用作漂白剂的是A.SO2B.NaClOC.Ca(ClO)2D.H2SO4(浓硫酸)
- 在甲、乙、丙、丁四只集气瓶中分别装有Cl2、H2、HBr、HCl中的一种气体,甲、丁两瓶气体混合后见光会发生爆炸,甲、乙两瓶混合...
- 下列做法正确的是( )A.用无色试剂瓶盛放新制的氯水B.用10mL量筒量取3.24mL稀硫酸C.用蒸馏水鉴别溴蒸气和二氧化氮气体D....
- 下列选项与氯气的用途无关的是[ ]A.消毒灭菌B.制漂白粉C.从海水中提取食盐D.制盐酸
- 下列关于氯的说法正确的是( )A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂B.35 17Cl、37 17Cl为不同的核素,有不同...
- 向H2S的水溶液中通入一定量的Cl2,下列图像所示的变化正确的是[ ]A.B.C.D.