本试题 “按照要求回答下列问题写出下列变化的化学方程式:(1)实验室制乙烯(注明反应条件)______.(2)乙烯→氯乙烷______.已知:甲酸和乙酸相类似,具有下列性质...” 主要考查您对化学反应方程式
乙烯
乙醛
乙烯的制取
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式
- 乙烯
- 乙醛
- 乙烯的制取
化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
乙烯的结构和性质:
1.分子结构:
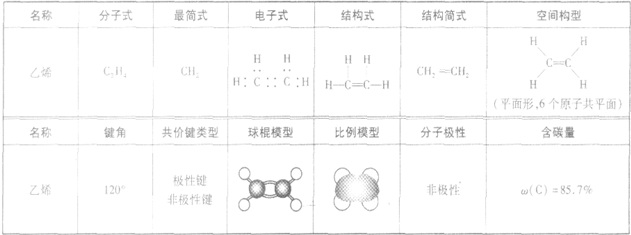
2.物理性质:
在通常状况下,乙烯是无色、稍有气味的气体,难溶于水,易溶于乙醇、乙醚等有机溶剂,密度(标准状况时为1.25g·L-1)比空气略小,因此实验室制取乙烯不用排空气法收集,而用排水法收集。
3.化学性质:
由于碳碳双键中的一个键易断裂,刚此乙烯的性质比较活泼,能发生加成、加聚反应,能使溴水和KMnO4溶液(酸性)褪色。
(1)乙烯易发生氧化反应
①乙烯的燃烧
乙烯在氧气或空气中易燃烧,完全燃烧生成CO2和H2O,反应的化学方程式为:
乙烯含碳量比较高,在一般情况下燃烧不是很充分,因此火焰明亮且伴有黑烟。
②乙烯的催化氧化

③乙烯能被酸性KMnO4溶液氧化
乙烯使酸性KMnO4溶液褪色的实质是乙烯被酸性KMnO4溶液氧化成二氧化碳和水。
(2)乙烯能发生加成反应
有机物分子中不饱和碳原子与其他原子(或原子团) 直接结合生成新的化合物的反应叫做加成反应。
乙烯使溴的四氯化碳溶液褪色的实质是乙烯与溴单质发生加成反应生成了1,2一二溴乙烷,反应的化学方程式为: 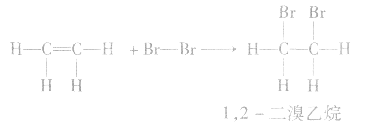
通常简写为
因此,可用溴水或溴的四氯化碳溶液鉴别乙烯和甲烷、乙烷等烷烃,也可用于除去甲烷中混有的乙烯。
(3)加聚反应在一定条件(温度、压强、催化剂)下,乙烯能发生加聚反应:
由相对分子质量小的化合物(单体)分子互相结合成相对分子质量很大的高分子的反应叫做聚合反应。由一种或多种不饱和化合物(单体)分子通过不饱和键互相加成而聚合成高分子化合物的反应叫做加成聚合反应,简称加聚反应。
乙烯的鉴别和除杂:
1.乙烯和其他物质的鉴别利用被鉴别物质性质的差异进行区分,要求操作简单、安全,现象明显,结论准确,以乙烷与乙烯的鉴别为例。操作:将两种气体分别通人酸性KMnO4溶液中。现象:一种气体使酸性KMnO4溶液褪色,一种气体不能使酸性KMnO4溶液褪色。结论:使酸性KMnO4溶液褪色者为乙烯,不能使酸性KMnO4溶液褪色者为乙烷.
2.除杂质乙烯除杂要求:将杂质除净,不能引入新杂质,小能对主要成分产生不利影响。如乙烷中混有乙烯,除杂的方法是用溴水洗气,乙烯与溴发生加成反应破除去,乙烷不反应逸出。
乙醛分子结构: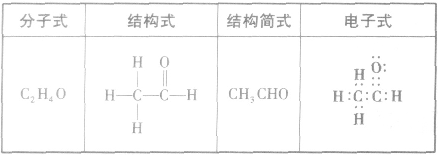
乙醛的性质:
1、物理性质
乙醛是无色、有刺激性气味的液体,密度小于水,沸点为20.8℃。乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。冈为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.化学性质
乙醛分子中的醛基(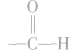 )对乙醛的主要化学性质起决定作用。
)对乙醛的主要化学性质起决定作用。
(1)加成反应
乙醛分子中醛基上的碳氧双键与碳碳双键相似,能够发生加成反应。如使乙醛蒸气和氢气的混合气体通过热的催化剂,乙醛与氢气即发生加成反应:
说明:a.乙醛的催化加氢反应也是还原反应。
b.常见的能发生加成反应的官能团(或基团)有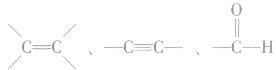 等,但它们发生加成反应的条件不同。
等,但它们发生加成反应的条件不同。
c.由乙醇的催化氧化反应和乙醛的催化加氢反应可知,乙醇和乙醛可在一定条件下相互转化: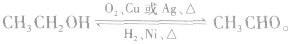
(2)氧化反应
①与银氨溶液的反应——银镜反应
Ag(NH3)2OH(氢氧化二氨合银)是一种弱氧化剂,能把乙醛氧化成乙酸,乙酸又与氨反应生成乙酸铵,而Ag+被还原成金属银附着在试管壁上,形成银镜,所以,这个反应叫做银镜反应。银镜反应常用来检验醛基的存在。工业上可利用这一反应原理,把银均匀地镀在玻璃上制成镜子或保温瓶胆(生产上常用含有醛基的葡萄糖作为还原剂)。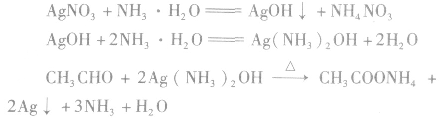
注意a.实验所用试管(玻璃)要洁净。
b.银氨溶液要新配制的,配制银氨溶液是向 AgNO3稀溶液中逐滴加入稀氨水,直到最初生成的沉淀恰好溶解为止。要防止氨水过量,并且必须随配随用,不可久置,否则会生成容易爆炸的物质。
c.实验条件是水浴加热,不能直接加热煮沸。
②与新制氢氧化铜的反应在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4~6滴,得到新制的氢氧化铜,振荡后加入乙醛溶液0.5mL,加热煮沸。观察并记录实验现象。
实验现象:生成红色沉淀。
实验结论:在加热的条件下,乙醛能与新制的氢氧化铜发生化学反应。
乙醛与新制的氢氧化铜反应的实验中,涉及的主要化学反应是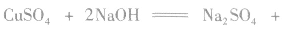
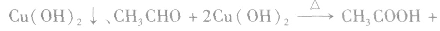
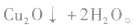 反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
反应中新制的氢氧化铜将乙醛氧化为乙酸,它本身被还原为氧化亚铜(Cu2O)。Cu2O是红色固体,不溶于水,也不与乙酸反应。
乙醛与新制的氢氧化铜的反应原理,可用于在实验室里检验醛基的存在,在医疗上检验尿糖。
说明:a.制备新制的Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应保持碱过量;
b.反应条件必须是加热到沸腾。
③与氧气的反应乙醛如在一定温度和催化剂存在的条件下,也能被空气中的氧气氧化成乙酸:
在点燃的条件下,乙醛能在空气或氧气中燃烧。 乙醛完全燃烧的化学方程式为: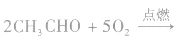
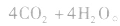
注意a.在工业上,可以利用乙醛的催化氧化反应制取乙酸。
b.银氨溶液、新制氢氧化铜的氧化性很弱,乙醛能被这样的弱氧化剂氧化,原因是乙醛的还原性很强。由此推理,乙醛也易被酸性高锰酸钾溶液、溴水等氧化,高锰酸钾、溴被还原而使溶液褪色。
乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O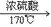 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图: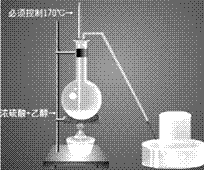
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有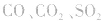 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有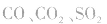 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: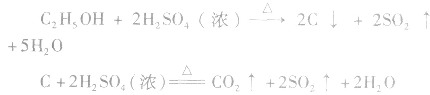
与“按照要求回答下列问题写出下列变化的化学方程式:(1)实验室...”考查相似的试题有:
- (1)用1 L 1.0 mol/LNaOH溶液吸收35.2 g CO2气体,溶液中CO32-与HCO3-的物质的量之比为1∶3;反应的化学方程式为____________...
- m g某金属M与含n mol HCl的盐酸恰好完全反应,生成MCl2和H2,则该金属的相对原子质量为( )A.2mnB.2nmC.n2mD.m2n
- 自然界存在着一种白云石的矿石,其化学式是xCaCO3•yMgCO3.以它为原料,可制取耐火材料等.(1)称取27.6g白云石,加热到质量...
- 在常温常压下,取下列四种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )A.CH4B.C2H6C.C3H8D.C4H10
- 关于乙烯的化学性质,说法正确的是A.不能发生聚合反应B.能使溴水褪色C.可与H2发生加成反应D.可与HCl加成
- 下列说法正确的是( )A.乙烯和苯都能使酸性KMnO4溶液褪色B.乙醇和乙醛均能发生氧化反应生成乙酸C.淀粉和聚乙烯都是天然高...
- 以下实验合理的是( )A.用酸性KMnO4溶液除去乙烷中的乙烯B.将铁屑、溴水、苯混合制溴苯C.在苯和硝基苯采用蒸馏的方法分离...
- 柠檬醛是一种用于合成香料的工业原料。经分析测定柠檬醛分子结构呈链状,碳原子的排列方式可以划分为若干个异戊二烯()分子的...
- 用一种试剂鉴别苯酚溶液、己烯、碘化钾溶液、苯四种液体,可选用( )A.盐酸B.FeCl3溶液C.溴水D.四氯化碳
- 请完成有关氨气的问题。(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。(2)若实验室收集...