本试题 “乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:①2CO2(g)+6H2(g)催化剂CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011②2CO(g)+4H2(g)催化...” 主要考查您对盖斯定律
化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盖斯定律
- 化学平衡常数
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: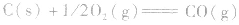 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
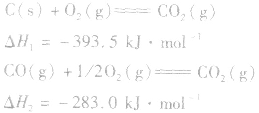
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
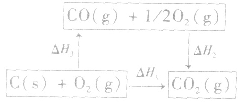
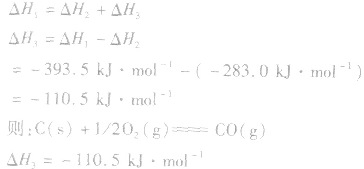
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
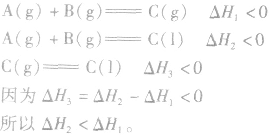
若按以下思路分析:
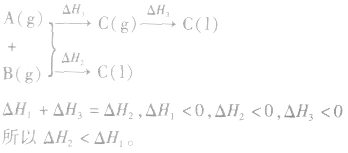
2.同一反应物状态不同时
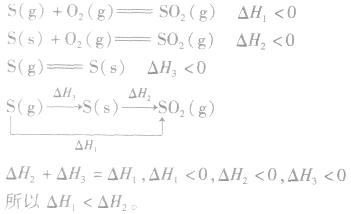
3.两个有联系的不同反应相比
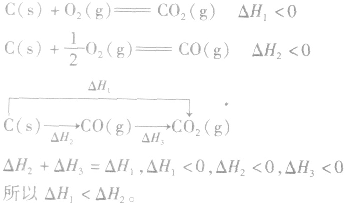
并且据此可写出下面的热化学方程式:

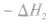
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
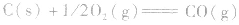 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。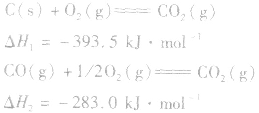
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
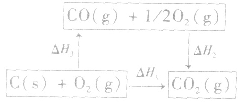
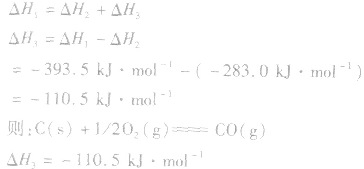
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
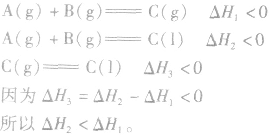
若按以下思路分析:
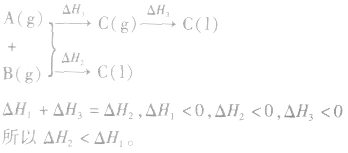
2.同一反应物状态不同时
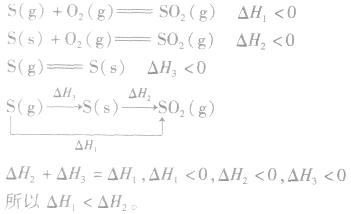
3.两个有联系的不同反应相比
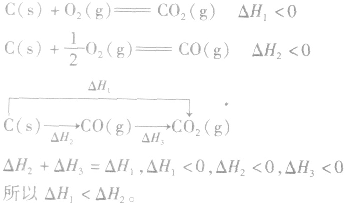
并且据此可写出下面的热化学方程式:

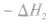
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g) pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: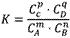
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
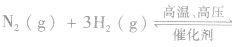


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
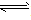 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: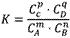
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
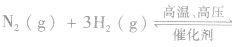


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇...”考查相似的试题有:
- 下列与化学反应能量变化相关的叙述正确的是[ ]A.生成物能量一定低于反应物总能量B.放热反应的反应速率总是大于吸热反应的反...
- 某温度下,在一容积可变的容器里,反应2A(g)B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温...
- 乙酸、乙醇生成乙酸乙酯的反应是可逆反应,反应一段时间后,达到化学平衡状态。下列描述能说明乙酸与乙醇的酯化反应已经达到...
- (6分)可逆反应①X(g)+2Y(g)2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔...
- 已知某可逆反应,x A(g)y B(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器体积扩大到原来的两倍,再达到平衡时,...
- 已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) ...
- 某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是( )物质XYZW初始浓度/mol·L-10.50.6...
- 在一定温度下,向2L体积固定的密闭容器中加入lmolHI,,的物质的量随时间的变化如图示,下列说法正确的是A.该温度下,反应的...
- 把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应3M (g) + N (g)xP (g) +2Q (g),5min反应达到平衡,已知M的转化率...
- (8分)在恒温恒容的密闭容器中,通入xmol N2和ymol H2发生反应N2+ 3H22NH3,达平衡后,测得反应放出的热量为18.4 kJ,混合气...