本试题 “下列叙述正确的是( )A.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物B.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键C.强电解...” 主要考查您对离子化合物
化学键与化学反应中能量变化的关系
强电解质、弱电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 离子化合物
- 化学键与化学反应中能量变化的关系
- 强电解质、弱电解质
定义:
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
含有离子键的化合物称为离子化合物,离子化合物中肯定存在离子键,也可以存在共价键。
化学键与化学反应中能量变化的关系:
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。
断开化学键要吸收能量,形成化学键要释放能量,通过化学键的键能可以计算断开化学键或形成化学键所需的能量。
反应热与键能的关系:
化学反应的热效应来源于化学反应过程中断裂旧化学键并形成新化学键时的能量变化。当破坏旧化学键所吸收的能量小于形成新化学键所释放的能量时,为放热反应;
当破坏旧化学键所吸收的能量大于形成新化学键所释放的能量时,为吸热反应。

若
 反应为放热反应;若
反应为放热反应;若 或
或 ,反应为吸热反应。
,反应为吸热反应。强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“ ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
 ”表示。
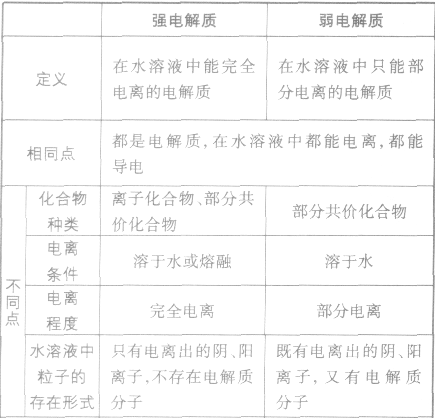
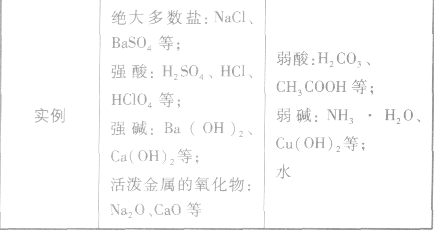
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如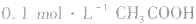 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
发现相似题
与“下列叙述正确的是( )A.一种元素可能有多种氧化物,但同种...”考查相似的试题有:
- 现有如下各种说法,正确的是( )①在水中氢、氧原子间均以化学键相结合②分子中键能越大,键长越长,则分子越稳定③干冰受热变...
- 下列反应中属于吸热反应的是( )A.CaO+H2O===Ca(OH)2B.C+H2OCO+H2C.HCl+NaOH===NaCl+H2OD.2Al+3H2SO4===Al2(SO4)3+...
- 下列各组物质既有离键又共价键的A.KOH、H2SO4、NH4ClB.CaO、Na2CO3、NH4HCO3C.K2O2、NaOH、K2SO4D.HclO、Al2O3、MgCl2
- 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.(1)砷原子核外电子排布式为...
- .根据下表中所列键能数据,判断下列分子中,最不稳定的分子是化学键H—HH—ClH—ICl—ClBr—Br键能/ kJ/mol436431299247193A. B....
- 下列物质中,不属于电解质的 ( )A NaOH B H2SO4 C 蔗糖 D NaCl
- 下列电离方程式中正确的是( )A.NaHCO3=Na++HCO3-B.Na2SO4=2Na++SO4-2C.Ca(NO3)2=Ca2++2(NO3)2-D.KClO3=K+...
- 下列说法正确的是( ) A.“钡餐”中使用的硫酸钡是弱电解质 B.Zn具有导电性和还原性,可用作锌锰干电池的负极材料 C.和是中...
- (2分)现有以下物质①NaCl溶液②干冰(固态的二氧化碳)③冰醋酸(纯净的醋酸)④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧熔融的KNO3,其中属于电解质...
- 电解质溶液中,下列叙述正确的是( )A.阳离子和阴离子数目一定相等 B.阳离子带的正电荷总数一定等于阴离子所带的负电荷总...